
| A. | 需要用到的仪器是酒精灯,烧杯,温度计,量筒,环形玻璃搅拌棒 | |
| B. | 中和热测定可以是所有的酸和碱 | |
| C. | 环形玻璃搅拌棒的搅拌方式是上下搅动 | |
| D. | 实验所取NaOH物质的量稍大于HCl,会导致中和热的数值偏高 |
分析 A.中和热测定中不需要酒精灯;
B.浓硫酸或弱电解质的酸碱影响反应热,所以一般用稀的强酸与强碱反应测定中和热;
C.环形玻璃棒的搅拌方式与普通玻璃棒不同,采用上下搅动的方式进行搅拌,
D.为了使氢离子完全反应,氢氧化钠的物质的量应该稍大些,不影响测定结果.
解答 解:A.中和热测定中不需要加热,则不会使用酒精灯,故A错误;
B.中和热测定中,通常用稀的强酸与强碱溶液,不是所有的酸和碱,故B错误;
C.在中和热测定实验中,环形玻璃搅拌棒搅拌溶液的方法是上下搅拌,使溶液混合均匀,故C正确;
D.中和热测定中,为了减小误差,使酸中氢离子完全反应,实验所取NaOH物质的量稍大于HCl,该措施不会导致中和热的数值偏高,故D错误;
故选C.
点评 本题考查了中和热的测定,题目难度不大,明确中和热测定原理为解答关键,注意掌握实验操作步骤、使用仪器及误差分析方法,试题培养了学生的分析能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验现象 | 相关解释 | |
| A | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
| B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
| C | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
| D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | 2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑有氧气生成,不能说明NO2有助燃性. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
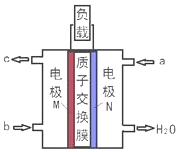 甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式2CH4O+3O2═2CO2+4H2O,下图是该燃料电池的示意图.下列说法正确的是( )
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式2CH4O+3O2═2CO2+4H2O,下图是该燃料电池的示意图.下列说法正确的是( )| A. | a是甲醇燃料、b是氧气 | |
| B. | 当转移6mol e-时,消耗33.6L O2 | |
| C. | 负极反应:CH4O-6e-+H2O═CO2↑+6H+ | |
| D. | 质子从N电极区穿过交换膜移向M电极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHB溶液呈酸性,说明H2B为强酸 | |
| C. | NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | |
| D. | 0.1mol/L CH3COOH和0.05mol/L NaOH溶液等体积混合,所得溶液中:2c(Na+)═c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L | B. | 1.0 mol/L | C. | 1.5 mol/L | D. | 2.0 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 100℃时,纯水中c(H +)=1×10-6 mol•L-1,此时纯水显酸性 | |
| C. | 等体积pH=12 NaOH溶液和pH=2 CH3COOH溶液混合,混合后溶液pH>7 | |
| D. | 1mol/L醋酸溶液加水稀释,溶液中所有离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 g氢气在氧气中完全燃烧生成气态水,放出的热量为120.9 kJ,氢气的燃烧热大于 241.8 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放出的热量为19.3 kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 常温下,若反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | 已知中和热为-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com