
分析 (1)令铁和锌的物质的量分别为amol、bmol,利用二者质量之和与生成氢气的物质的量之和,列方程计算a、b的值,再根据m=nM计算铁的质量;
(2)根据H元素守恒计算出HCl的物质的量,再根据c=$\frac{n}{V}$计算出盐酸的浓度.;
(3)锌与盐酸反应生成锌离子和氢气,锌失电子,氢离子得电子,转移电子数为2e-.
解答 解:(1)令铁和锌的物质的量分别为amol、bmol,则:
Fe~~~~H2
amol amol
Zn~~~~H2
bmol bmol
所以$\left\{\begin{array}{l}{a+b=0.15}\\{56a+65b=9.3}\end{array}\right.$
解得:a=0.05,b=0.1
故混合物铁的质量为0.05mol×56g/mol=2.8g,
故答案为:2.8;
(2)标准状况下3.36L H2的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,所以根据H元素守恒,则HCl的物质的量为0.15mol×2=0.3mol,所以c=$\frac{n}{V}$=$\frac{0.3mol}{0.5L}$=0.6mol/L;
故答案为:0.6;
(3)锌与盐酸反应生成锌离子和氢气,其中锌失电子,氢离子得电子,转移电子数为2e-,所以用双线桥表示电子转移为: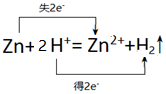 ,故答案为:
,故答案为: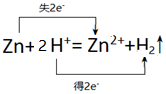 .
.
点评 本题考查常用化学计量的有关计算以及用双线桥表示电子转移,根据方程式进行的计算,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
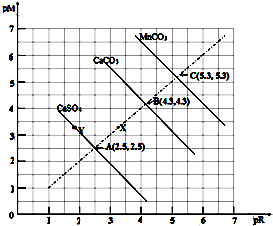
| A. | MnCO3在常温下的Ksp=2.5 x10-11(已知100.4=2.5) | |
| B. | 三种物质在常温下的溶解度大小顺序为MnCO3>CaCO3>CaSO4 | |
| C. | 处于Y点的CaSO4溶液中c(Ca2+)>c(SO42-) | |
| D. | Ca2+、CO32-浓度为X点的溶液可通过蒸发溶剂变为B点的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28 g 14CO和N2的混合物所含的质子数为14NA | |
| B. | 常温下,100mL 1mol•L-1 Na2CO3溶液中阴离子总数大于0.1NA | |
| C. | 将NA个NH3分子溶于1 L水中得到1 mol•L-1的氨水 | |
| D. | 将标况下22.4LC12通入足量NaOH溶液中充分反应转移电子数是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
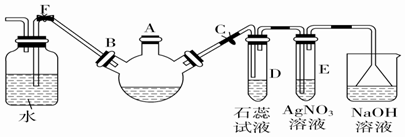
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、O2、SO3中 | B. | SO3中 | C. | SO2、O2中 | D. | SO2、SO3中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com