
 目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1
目前工业合成氨的原理是N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1分析 (1)已知:①2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+l530.0kJ•mol-1,
②N2(g)+3H2(g)=2NH3(g)△H=-93.0kJ•mol-1,
根据盖斯定律,(②×2-①)÷6可得:H2(g)+$\frac{1}{2}$O2(g)=H2O(l);
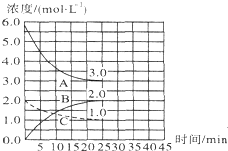
(2)①根据图象可知,反应进行到25min时曲线A减少了6mol/L-3mol/L=3mol/L,C减少了2.0mol/L-1.0mol/L=1.0mol/L,因此根据方程式可知表示N2浓度变化的曲线是C;
②前25 min内,氢气浓度减少了3mol/L,根据v=$\frac{△c}{△t}$计算用H2浓度变化表示的化学反应速率;
③在25 min末刚好平衡,此时氮气、氢气和氨气的浓度分别是1.0mol/L、3mol/L、2mol/L,再根据K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$计算平衡常数;
(3)A.正反应是体积减少的可逆反应,因此在恒温恒压下气体体积不再变化时已平衡;
B.在反应过程中质量始终不变,但容器容积是变化的,所以密度是变化的,因此气体密度不再变化说明反应达到平衡;
C.平衡后,往装置中通入一定量Ar,压强不变,容器容积增加,浓度降低,平衡向逆反应方向移动;
D.平衡后,压缩容器,压强增大,平衡向正反应方向进行.
解答 解:(1)已知:①2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+l530.0kJ•mol-1,
②N2(g)+3H2(g)=2NH3(g)△H=-93.0kJ•mol-1,
根据盖斯定律,(②×2-①)÷6可得:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol;
(2)①根据图象可知,反应进行到25min时曲线A减少了6mol/L-3mol/L=3mol/L,C减少了2.0mol/L-1.0mol/L=1.0mol/L,因此根据方程式可知表示N2浓度变化的曲线是C;
②前25 min内,氢气浓度减少了3mol/L,则用H2浓度变化表示的化学反应速率是3mol/L÷25min=0.12 mol•L-•min-1,
故答案为:0.12 mol•L-•min-1;
③在25 min末刚好平衡,此时氮气、氢气和氨气的浓度分别是1.0mol/L、3mol/L、2mol/L,则平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{{2}^{2}}{1×{3}^{3}}$=$\frac{4}{27}$,
故答案为:$\frac{4}{27}$;
(3)A.正反应是气体物质的量减小的反应,恒温恒压下,随反应进行体积减少,因此在恒温恒压下气体体积不再变化时已平衡,故A正确;
B.在反应过程中质量始终不变,但容器容积是变化的,所以密度是变化的,因此气体密度不再变化说明反应达到平衡,故B错误;
C.平衡后,往装置中通入一定量Ar,压强不变,容器容积增加,浓度降低,平衡向逆反应方向移动,故C错误;
D.平衡后,压缩容器,压强增大,平衡向正反应方向进行,因此生成更多NH3,故D正确,
故选:AD.
点评 本题考查盖斯定律、化学平衡图象、外界条件对平衡状态影响、反应速率与平衡常数计算等,难度不大,注意对基础知识的理解掌握.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
 “霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
“霾”是当今世界环境热点话题.目前我国许多地方空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应:CO(g)+3H2(g)?CH4(g)+H2O(g).起始以物质的量之比为1:1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲).下列有关说法正确的是( )
已知反应:CO(g)+3H2(g)?CH4(g)+H2O(g).起始以物质的量之比为1:1充入反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为▲).下列有关说法正确的是( )| A. | 上述反应的△H<0 | |
| B. | N点时的反应速率一定比M点快 | |
| C. | 降低温度,H2的转化率可达到100% | |
| D. | 工业用此法制取甲烷应采用更高的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L 0.5mol/LNa2S溶液中含有的S2-个数为NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molSO2与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H3>△H1 | |
| C. | 若用0.2 mol CH4还原NO2至N2,则反应中放出的热量一定为173.4 kJ | |
| D. | 若用标准状况下2.24 L CH4还原NO2至N2,整个过程中转移的电子为1.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3可用作耐火材料 | |
| B. | Al(OH3)可用于中和胃酸过多 | |
| C. | Na2O2可用于呼吸面具和潜艇中作氧气的来源 | |
| D. | NaHCO3的水溶液呈碱性,因此NaHCO3不能用作食品添加剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com