
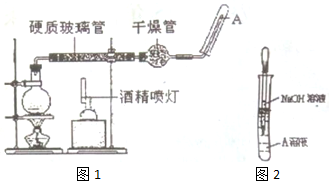
分析 (1)Fe与水蒸气反应生成四氧化三铁与氢气;计算Fe的物质的量,根据方程式计算生成氢气物质的量,结合H元素化合价变化计算转移电子物质的量;
(2)作为铁粉的载体,增大与水蒸气接触面积;
(3)为实验提供水蒸气;
(4)加入氢氧化钠溶液只观察到生成白色沉淀变成灰绿色,最后变成红褐色的现象,说明溶液A中含有硫酸亚铁,没有硫酸铁,生成的氢氧化亚铁沉淀被氧化为氢氧化铁;
向另一支试管中滴加KSCN溶液,若溶液变红色,说明溶液中含有铁离子,不能说明Fe粉过量,若溶液未变红色,说明溶液中没有铁离子,过量的Fe与铁离子反应生成亚铁离子.
解答 解:(1)Fe与水蒸气反应生成四氧化三铁与氢气,反应方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe 3O4+4 H2,Fe的物质的量为$\frac{8.4g}{56g/mol}$=0.15mol,根据方程式可知生成氢气物质的量为0.15mol×$\frac{4}{3}$=0.2mol,结合H元素化合价变化可知转移电子物质的量为0.2mol×2=0.4mol,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe 3O4+4 H2;0.4;
(2)玻璃管中石棉绒的作用是:作为铁粉的载体,增大与水蒸气接触面积,有利于充分反应,
故答案为:铁粉的载体,增大与水蒸气接触面积;
(3)G加入后生成水蒸气,为实验提供水蒸气,
故答案为:为实验提供水蒸气;
(4)四氧化三铁与硫酸反应生成硫酸亚铁、硫酸铁,A溶液中加入氢氧化钠溶液只观察到生成白色沉淀变成灰绿色,最后变成红褐色的现象,说明溶液A中含有硫酸亚铁,没有硫酸铁,过量的Fe与铁离子反应生成亚铁离子,能说明有过量的铁,生成的氢氧化亚铁沉淀被氧化为氢氧化铁,反应离子方程式为:4Fe(OH) 2+O2+2H2O(g)=Fe(OH) 3,
向另一支试管中滴加KSCN溶液,若溶液变红色,说明溶液中含有铁离子,不能说明有过量的铁,若溶液未变红色,说明溶液中没有铁离子,过量的Fe与铁离子反应生成亚铁离子,反应离子方程式为:Fe+2Fe3+=3Fe2+,
故答案为:能;(OH) 2+O2+2H2O(g)=Fe(OH) 3;不能;能;Fe+2Fe3+=3Fe2+.
点评 本题考查实验方案设计与评价,熟练掌握元素化合物性质、明确实验原理,题目难度不大.


科目:高中化学 来源: 题型:多选题
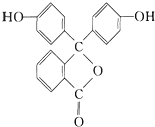
| A. | 酚酞具有弱酸性,且属于芳香族化合物 | |
| B. | 酚酞的分子式为C20H12O4 | |
| C. | 1mol酚酞最多与2molNaOH发生反应 | |
| D. | 酚酞在碱性条件下能够发生水解反应,呈现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1HCl溶液 | B. | 1mol•L-1MgCl2溶液 | ||
| C. | 2mol•L-1NaCl溶液 | D. | 1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe2+ | |
| B. | 能使紫色石蕊试液变红的溶液:Fe2+、Mg2+、MnO4-、Cl- | |
| C. | 常温pH<7的溶液K+、Ba2+、Cl-、Br- | |
| D. | 碳酸氢钠溶液K+、SO42-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物 干冰 CO2 | B. | 碱 纯碱 Na2CO3 | ||
| C. | 酸 硫酸 H2SO3 | D. | 单质 氯水 Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| B. | 0.5mol/L MgCl2溶液中,含有Cl-离子数为NA | |
| C. | 2.24L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| D. | 标准状况下,22.4L H2O含有氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
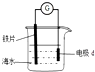
| A. | d为锌块,铁片腐蚀加快 | |
| B. | d为石墨,铁片不易被腐蚀 | |
| C. | d为锌块,铁片上电极反应为:2H++2e-=H2↑ | |
| D. | d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeC13+Cu=CuC12+2FeC12 | B. | AlCl3+3NH3•H20=Al(0H)3↓+3NH4Cl | ||
| C. | 2Fe(0H)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe203+3H20 | D. | Na2O+CO2=Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com