
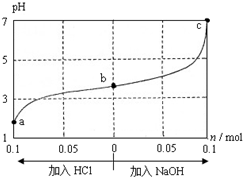
| A. | a、b、c 对应的混合液中,水的电离程度由大到小的顺序的是a>b>c | |
| B. | c点混合液中c(Na+)>c(CH3COO-) | |
| C. | 加入NaOH过程中,$\frac{c(N{a}^{+})×c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| D. | 若忽略体积变化,则25℃时CH3COOH的电离平衡常数 K=$\frac{0.2}{w-0.2}$×10-7 mol•L-1 |
分析 1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,混合后溶液的pH<5,显酸性,说明醋酸过量,溶液中溶质为CH3COOH和CH3COONa;加盐酸时,CH3COONa与盐酸反应生成CH3COOH;加NaOH时,NaOH与CH3COOH反应生成CH3COONa;
A.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小;
B.c点pH=7,根据电荷守恒分析;
C.加入NaOH过程中,c(Na+)和c(OH-)增大,c(Na+)的增大大于c(CH3COO-)的增大;
D.pH=7时,c(H+)=10-7mol•L-1,根据Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$计算.
解答 解:1.0L w mol•L-1 CH3COOH溶液与0.1mol NaOH固体混合,混合后溶液的pH<5,显酸性,说明醋酸过量,溶液中溶质为CH3COOH和CH3COONa;加盐酸时,CH3COONa与盐酸反应生成CH3COOH;加NaOH时,NaOH与CH3COOH反应生成CH3COONa;
A.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c三点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是c>b>a,故A错误;
B.c点pH=7,则c(H+)=c(OH-),溶液中电荷守恒为:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以c(Na+)=c(CH3COO-),故B错误;
C.加入NaOH过程中,c(Na+)和c(OH-)增大,c(Na+)的增大大于c(CH3COO-)的增大,所以加入NaOH过程中,$\frac{c(N{a}^{+})×c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$增大,故C错误;
D.pH=7时,c(H+)=10-7mol•L-1,c(Na+)=c(CH3COO-)=0.2mol/L,Ka=$\frac{c(C{H}_{3}CO{O}^{-})×c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{0.2}{w-0.2}$×10-7 mol•L-1,故D正确.
故选D.
点评 本题考查了弱电解质的电离、电离常数的计算、溶液中守恒关系的应用等,题目难度中等,注意把握电离常数的计算和电荷守恒的应用,侧重于考查学生的分析能力和对基础知识的应用能力、计算能力.


科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 | |
| B. | 工业废水可经过“再生”处理,用于城市道路保洁、喷泉和浇花用水 | |
| C. | 硅单质常作为制备光导纤维的主要材料 | |
| D. | 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L O2和O3的混合气中氧原子数为0.2NA | |
| B. | 标准状况下,22.4 L苯的分子数为NA | |
| C. | 46 g乙醇中含有的共价键总数为8 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热剂 | B. | 黑火药 | C. | 木炭 | D. | 丹药(硫化汞) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl只存在一种空间结构 | |
| B. | CH2Cl2只存在一种空间结构 | |
| C. | CHCl3只存在一种空间结构 | |
| D. | CH4的四个价键的键角和键长都相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
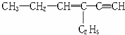 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,在同一平面上的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,在同一平面上的碳原子数最多为c,则a、b、c分别为( )| A. | 4,3,6 | B. | 4,3,8 | C. | 2,5,4 | D. | 4,4,6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com