
| A. | 只有②⑥ | B. | 只有①⑥ | C. | 只有⑥ | D. | 只有①④⑥ |
分析 一般金属元素与非金属元素形成离子键,非金属元素之间形成共价键,不同种非金属元素形成极性共价键,同种非金属元素形成非极性键,含离子键的化合物一定为离子化合物,共价化合物中一定不含离子键,以此来解答.
解答 解:①两种原子构成的共价化合物分子中的化学键不一定都是极性键,如H2O2中既有极性键也有非极性键,故①错误;
②两种不同非金属元素原子间形成的化学键都是极性共价键,如HCl,故②正确;
③含有非极性键的化合物不一定是共价化合物,如Na2O2,离子化合物的熔点不一定比共价化合物的熔点高,如二氧化硅的熔点大于NaCl的,故③错误;
④难失去电子的原子,不一定易形成阴离子,如稀有气体等,故④错误;
⑤单质分子中可能存在化学键,如氢气中含有H-H键,而稀有气体中没有化学键,多原子构成的分子中含有共价键,化合物的分子一定存在化学键,故⑤错误;
⑥离子化合物是阴阳离子间通过离子键形成的化合物,所以离子化合物中一定含有离子键,故⑥正确;
故选A.
点评 本题考查化学键,熟悉化学键形成的一般规律及常见物质中的化学键即可解答,并注意利用实例来解答,难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:填空题

| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 明矾具有消毒杀菌的作用 |
| B | 含硫煤中加入适量石灰石可减少对大气的污染 | 使煤燃烧产生的SO2最终生成CaSO4 |
| C | 钢铁在海水中比在河水中更易腐蚀 | 海水中含氧量高于河水 |
| D | “地沟油”可以用来制生物柴油 | 其主要成分和从石油中提取的柴油类似 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20s后,混合气中n(H2):n(N2):n(NH3)=1:2:3 | |
| B. | N2的转化率为30% | |
| C. | 20s内H2的平均反应速率为1.5mol•L-1•s-1 | |
| D. | NH3的体积分数为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
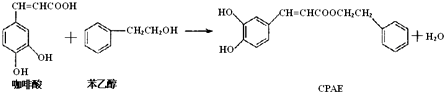
| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| D. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | X与Y的简单离子可能具有相同的电子层结构 | |
| C. | 两元素形成的化合物中,原子个数比可能为1:1 | |
| D. | X与Y不可能位于同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用结晶法除去硝酸钾中的氯化钠杂质 | |
| B. | 用蒸馏法分离苯和溴苯 | |
| C. | 用分液法分离水和酒精 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的少量HCl气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com