B
分析:标准状况下2.24LH
2和Cl
2组成的混合气体的物质的量为0.1mol,最终有NaClO生成,说明氢气与氯气反应氯气有剩余,故混合气体中氯气的物质的量大于0.05mol,NaOH的物质的量为0.1L×1mol/L=0.1mol,由于HCl与NaOH反应生成NaCl,Cl
2与NaOH反应生成NaCl、NaClO,由钠原子与氯原子关系可知,NaOH不足,根据n=cV计算NaClO的物质的量,根据方程式Cl
2+2NaOH=NaClO+NaCl+H
2O计算与剩余氯气反应的NaOH的物质的量,进而计算与HCl反应的NaOH的物质的量,再计算HCl的物质的量,根据氢元素守恒计算氢气的物质的量,进而计算混合物中氯气的物质的量,据此解答.
解答:标准状况下2.24LH
2和Cl
2组成的混合气体的物质的量为
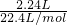
=0.1mol,最终有NaClO生成,说明氢气与氯气反应氯气有剩余,由于氢气与氯气按1:1反应,故混合气体中氯气的物质的量大于0.05mol,NaOH的物质的量为0.1L×1mol/L=0.1mol,由于HCl与NaOH反应生成NaCl,Cl
2与NaOH反应生成NaCl、NaClO,由钠原子与氯原子关系可知,NaOH不足,反应生成NaClO的物质的量为0.1L×0.1mol/L=0.01mol,根据方程式Cl
2+2NaOH=NaClO+NaCl+H
2O可知,与剩余氯气反应的NaOH的物质的量为0.01mol×2=0.02mol,
故与HCl反应的NaOH的物质的量为0.1mol-0.02mol=0.08mol,由HCl+NaOH=NaCl+H
2O可知,HCl的物质的量为0.08mol,根据氢元素守恒可知氢气的物质的量为
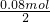
=0.04mol,故混合物中氯气的物质的量为0.1mol-0.04mol=0.06mol,氯气的体积分数为

×100%=60%,
故选B.
点评:本题考查混合物的有关计算,难度较大,根据氯原子与钠原子关系,判断混合气体反应后剩余的氯气与氢氧化钠反应氢氧化钠的量不足是解题关键,为易错题,容易认为剩余的氯气被氢氧化钠完全吸收,

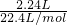 =0.1mol,最终有NaClO生成,说明氢气与氯气反应氯气有剩余,由于氢气与氯气按1:1反应,故混合气体中氯气的物质的量大于0.05mol,NaOH的物质的量为0.1L×1mol/L=0.1mol,由于HCl与NaOH反应生成NaCl,Cl2与NaOH反应生成NaCl、NaClO,由钠原子与氯原子关系可知,NaOH不足,反应生成NaClO的物质的量为0.1L×0.1mol/L=0.01mol,根据方程式Cl2+2NaOH=NaClO+NaCl+H2O可知,与剩余氯气反应的NaOH的物质的量为0.01mol×2=0.02mol,
=0.1mol,最终有NaClO生成,说明氢气与氯气反应氯气有剩余,由于氢气与氯气按1:1反应,故混合气体中氯气的物质的量大于0.05mol,NaOH的物质的量为0.1L×1mol/L=0.1mol,由于HCl与NaOH反应生成NaCl,Cl2与NaOH反应生成NaCl、NaClO,由钠原子与氯原子关系可知,NaOH不足,反应生成NaClO的物质的量为0.1L×0.1mol/L=0.01mol,根据方程式Cl2+2NaOH=NaClO+NaCl+H2O可知,与剩余氯气反应的NaOH的物质的量为0.01mol×2=0.02mol,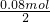 =0.04mol,故混合物中氯气的物质的量为0.1mol-0.04mol=0.06mol,氯气的体积分数为
=0.04mol,故混合物中氯气的物质的量为0.1mol-0.04mol=0.06mol,氯气的体积分数为 ×100%=60%,
×100%=60%,

 名校课堂系列答案
名校课堂系列答案 回答下列问题:
回答下列问题: