
| A. | 1标准大气压下原子数为NA的水蒸气为1mol | |
| B. | 1L1mol/L的NaOH溶液中Na+的物质的量为1mol | |
| C. | 标准状况下,22.4L氦气的质量为4g | |
| D. | 用含1molHCl的盐酸制取氯气,氯元素失去的电子数为4NA |
分析 A、水分子中含3个原子;
B、求出氢氧化钠的物质的量,然后根据氢氧化钠中含1个钠离子来分析;
C、求出氦气的物质的量,然后根据氦气的摩尔质量为4g/mol来计算;
D、用盐酸来制取氯气,氯元素由-1价变为0价.
解答 解:A、水分子中含3个原子,故含NA个原子的水的物质的量为$\frac{1}{3}$mol,故A错误;
B、溶液中氢氧化钠的物质的量n=CV=1mol/L×1L=1mol,而氢氧化钠中含1个钠离子,故1mol氢氧化钠中含1mol钠离子,故B正确;
C、标况下22.4L氦气的物质的量为1mol,而氦气的摩尔质量为4g/mol,故1mol氦气的质量为4g,故C正确;
D、用盐酸来制取氯气,氯元素由-1价变为0价,故用含1molHCl的盐酸来制取氯气,氯元素转移的电子为1mol,个数为NA个,故D错误.
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48 L重水(D2O)中含有的中子数为2NA | |
| B. | 0.1mol乙烯和乙醇(C2H5OH,蒸汽)混合物完全燃烧所消耗的氧分子数一定为0.3NA | |
| C. | 常温常压下,15g乙烷分子中含有的共价键数目为3NA | |
| D. | 273K,101kPa下,14g乙烯与丙烯混合物中含有碳原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、PO43-、Na+ | B. | H+、Fe2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | K+、H+、NO${\;}_{3}^{-}$、Na+ | D. | OH-、Br-、SO42-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 酒精能使蛋白质变性,可用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构及性质 |
| A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| B | B原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| C | C是常见化肥的主要元素,单质常温下呈气态 |
| D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| E | 通常情况下,E没有最高正化合价,其单质之一是空气的一种主要成分 |
| F | F是周期表中元素原子半径最小的,其单质常温下是密度最小的气体 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
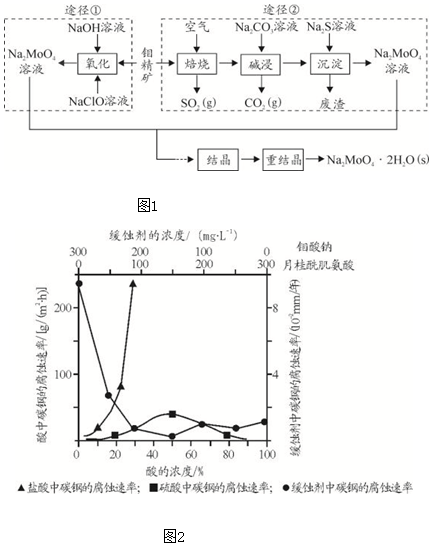
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a<b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为①<②<③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com