
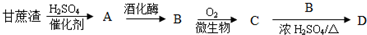
分析 根据各物质的转化关系,甘蔗渣在硫酸作催化剂的条件下水解得A为葡萄糖,葡萄糖在酒化酶的作用下生成B为CH3CH2OH,CH3CH2OH在微生物作用下被氧化成C为CH3COOH,CH3CH2OH与CH3COOH反应生成D为CH3COOCH2CH3,据此答题.
解答 解:根据各物质的转化关系,甘蔗渣在硫酸作催化剂的条件下水解得A为葡萄糖,葡萄糖在酒化酶的作用下生成B为CH3CH2OH,CH3CH2OH在微生物作用下被氧化成C为CH3COOH,CH3CH2OH与CH3COOH反应生成D为CH3COOCH2CH3,
(1)D为CH3COOH,D中的官能团为酯基,故答案为:酯基;
(2)根据上面的分析可知,“B→C”反应类型为氧化反应,故答案为:氧化反应;
(3)A为葡萄糖,化学式为C6H12O6,每摩尔C6H12O6完全燃烧时消耗O2的物质的量为6mol,B为CH3CH2OH,每摩尔CH3CH2OH完全燃烧时消耗O2的物质的量为3mol,C为CH3COOH,每摩尔CH3COOH完全燃烧时消耗O2的物质的量为2mol,所以等物质的量的A、B、C完全燃烧时消耗O2之比为6:3:2,
故答案为:6:3:2;
(4)在催化剂存在条件下,CH3CH2OH与乙烯发生加成反应得到不与金属Na反应的有机物应为,反应的化学方程式为CH3CH2OH+CH2=CH2$\stackrel{催化剂}{→}$CH3CH2OCH2CH3,
故答案为:CH3CH2OH+CH2=CH2$\stackrel{催化剂}{→}$CH3CH2OCH2CH3;
(5)从CH3CH2OH、CH3COOH、CH3COOCH2CH3的混合液中提纯CH3COOCH2CH3,可以向待提纯混合物中加入足量的饱和Na2CO3溶液,振荡、静止、分液,然后水洗、干燥,
故答案为:向待提纯混合物中加入足量的饱和Na2CO3溶液,振荡、静止、分液,然后水洗、干燥.
点评 本题考查有机物推断,注意根据反应条件进行推断,需要学生熟练掌握有机物的性质,难度不大,注意有机混合物的分离提纯方法.


科目:高中化学 来源: 题型:填空题
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
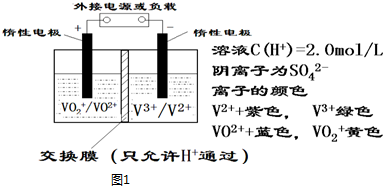
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
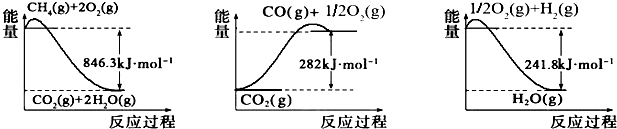
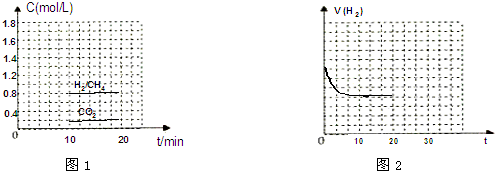
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,单晶硅可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | |
| C. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
| D. | 利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将20g硝酸钠和17g氯化钾放入100ml烧杯中,加35mL水,并加热、搅拌,使溶液浓缩至约为原来的一半时,趁热过滤即可得到硝酸钾晶体 | |
| B. | 焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀硫酸洗净并灼烧 | |
| C. | 中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果 | |
| D. | 移液管取液后,将移液管垂直伸入容器里面,松开食指使溶液全部流出,数秒后,取出移液管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
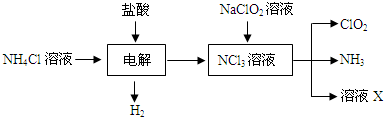
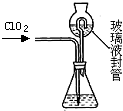
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com