
| A. | 391 | B. | 194 | C. | 516 | D. | 658 |
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 对于任何化学反应来说,反应速率越大,反应现象越明显 | |
| B. | 化学反应速率为“0.8mol/(L•min)”表示的意思是:时间为1s时,某物质的浓度为0.8mol/L | |
| C. | 化学反应达到平衡状态,反应停止 | |
| D. | 化学反应速率是定量描述化学反应快慢的物理量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由“C(石墨)═C(金刚石)△H=1.9 kJ•mol”可知,金刚石比石墨稳定 | |
| C. | 在101 kPa时,2 g H2 完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol | |
| D. | 在稀溶液中:H++OH-═H2O△H=-57.3 kJ•mol,若将含1 mol H2SO4与含2 mol NaOH的溶液混合,放出的热量等于114.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 溶解性 | 沸点 | 密度(g/mL) | |
| 乙醇 | 与水互溶 | 78.5 | 0.8 |
| 溴乙烷 | 难溶于水 | 38.4 | 1.4 |
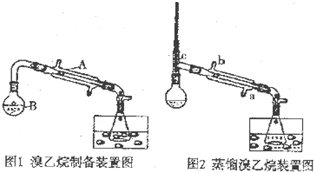
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | Si-O | O=O | Si-Si |
| 键能kJ•mol-1 | 460 | 498.8 | X |
| A. | 423.3 | B. | 352 | C. | 920 | D. | 176 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2022 kJ | B. | 2670 kJ | C. | 1698kJ | D. | 2346 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时,阳极附近 pH 值减小 | |
| B. | 充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O | |
| C. | 放电时,负极上发生反应的物质是Fe(OH)2 | |
| D. | 放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
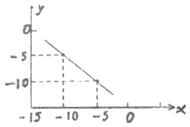 (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11 mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11 mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com