
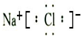 (2)H2H:H(3)MgCl2
(2)H2H:H(3)MgCl2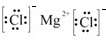
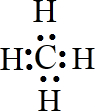 (5)CO2
(5)CO2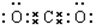 (6)Na2O
(6)Na2O
 ;O=C=O.
;O=C=O. 分析 (1)氯化钠为离子化合物,由钠离子和氯离子构成;
(2)氢气中两个氢原子通过共用1对电子达到稳定结构;
(3)氯化镁为离子化合物,氯化镁中存在镁离子和氯离子,氯离子还需要标出最外层电子;
(4)CH4 分子中,碳原子与4个氢原子分别共用一对电子,形成4个C-H键;
(5)二氧化碳中碳原子分别于两个氧原子共用2对电子达到稳定结构,存在两个碳氧键,C、O原子最外层都达到最外层8个电子;
(6)氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
只含共价键的为氢气、甲烷和二氧化碳,而将共用电子对用一条短线来代替所得到的式子即为结构式,据此分析.
解答 解:(1)NaCl为离子化合物,由钠离子与氯离子构成,电子式为: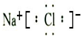 ,故答案为:
,故答案为: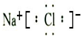 ;
;
(2)氢气中两个氢原子通过共用1对电子达到稳定结构,氢气的电子式为:H:H,只含共价键,;故答案为:H:H;
(3)MgCl2,氯化镁为离子化合物,化学式中存在阴阳离子,其电子式中需要标出阴阳离子所带电荷,氯化镁的电子式为: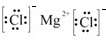 ,
,
故答案为: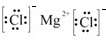 ;
;
(4)碳原子最外层的4个电子分别与氢原子形成共用电子对,电子式为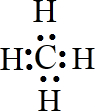 ,只含共价键,故答案为:
,只含共价键,故答案为: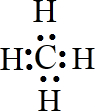 ;
;
(5)二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: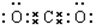 ,只含共价键,故答案为:
,只含共价键,故答案为: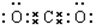 ;
;
(6)氧化钠为离子化合物,钠离子直接用离子符号表示,阳离子需要标出最外层电子及所带的电荷,氧化钠的电子式为: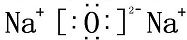 ,
,
故答案为: ;
;
只含共价键的为氢气、甲烷和二氧化碳,而将共用电子对用一条短线来代替所得到的式子即为结构式,故氢气的结构式为H-H,甲烷的结构式为 ,二氧化碳的结构式为O=C=O.
,二氧化碳的结构式为O=C=O.
故答案为:H-H; ;O=C=O;
;O=C=O;
点评 本题考查了常见物质的电子式和结构式的书写,应注意的是书写电子式之前先判断此化合物中的化学键的类型,难度不大.


科目:高中化学 来源: 题型:实验题
 探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.| 实验过程 | 冷水 | 热水 |
| 开始 | 红色扩散较慢 | 红色扩散较快 |
| 长久放置 | 最终均成为红色、均匀、透明的液体 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广燃煤脱硫技术,减少SO2污染,同时把煤粉碎了再燃烧以提高煤的燃烧效率 | |
| B. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖 | |
| C. | 推广煤的气化、液化技术,提供清洁燃料和化工原料 | |
| D. | 在汽车尾气处理器中使用新的催化剂,促使平衡2CO+2NO?2CO2+N2向正反应方向移动,减少污染物的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
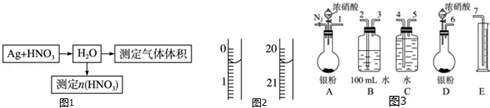
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该溶液中 c(H2CO3)>c(CO32-) | |
| B. | 常温下,该溶液的pH>7 | |
| C. | 该溶液中阳离子总数小于阴离子总数 | |
| D. | 常温下,加水稀释时$\frac{c({H}^{+})•c(C{O}_{3}^{2-})}{c({H}_{2}C{O}_{3})}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


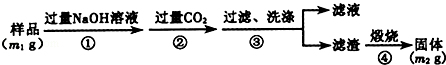
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com