
【题目】下列关于能量转换的认识中,不正确的是( )。
A. 电解水生成氢气和氧气时,电能转化为化学能
B. 绿色植物进行光合作用时,太阳能转化为化学能
C. 煤燃烧时,化学能主要转化为热能
D. 白炽灯工作时,电能全部转化为光能
科目:高中化学 来源: 题型:
【题目】由Na、Mg、Al、Fe四种金属单质中的两种组成的混合物共12g,跟足量盐酸反应,产生5.6L H2(标准状况下),由此可判断混合物中必定含有( )
A. Na B. Mg C. Al D. Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z均为中学化学里常见的化学物质,它们之间有如下图所示的转化关系。其中不符合图中转化关系的W、X依次是 ( )

A.W为O2,X为C
B.W为稀HCl,X为NaAlO2溶液
C.W为SO2,X为NaOH溶液
D.W为Cl2,X为Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性高锰酸钾溶液中加入过氧化钠粉末,溶液褪色,发生反应的离子方程式为2MnO4-+16H++5Na2O2=2Mn2++5O2↑+8H2O+10Na+。下列判断正确的是( )
A.Na2O2既是氧化剂,又是还原剂
B.O2是还原产物,Mn2+是氧化产物
C.通常用浓盐酸酸化高锰酸钾溶液
D.标准状况下,产生22.4 L O2时反应转移2 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含0.4 mol Al2(SO4)3的溶液中,含________mol SO![]() 。
。
(2)配制480mL 1mol/L 的NaOH溶液,需要称量氢氧化钠固体的质量为_______。
(3)若m g某气体中含分子数N个,已知阿伏加德罗常数为NA,则该气体的摩尔质量为____。
(4)O2和N2组成的混合气体的平均相对分子质量是31,则O2和N2的物质的量比为__________。
(5)在反应2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O中,氧化剂是________。
2ClO2↑+K2SO4+2CO2↑+2H2O中,氧化剂是________。
(6)分别取0.1mol 钠、镁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是 ____________;若0.2mol 钠、镁、铝分别放入到10mL 1mol/L 的盐酸中,在标准状况下,产生氢气体积分别为V1、V2、V3,则三者的大小顺序是____________(用V1、V2、V3填写)
(7)现有下列物质①NaCl晶体②干冰③HCl④铜⑤CaCO3固体⑥葡萄糖⑦酒精⑧熔融的KNO3⑨液氧⑩稀硫酸。以上物质能导电的是_________________。
(8)在粗盐提纯的实验中,判断BaCl2溶液过量的实验操作方法是______________。
(9)胃酸中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打,能治疗胃酸过多,请写出其反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物的知识是高中化学重要的组成部分,是考查化学基本概念和理论、化学计算、化学实验知识的载体。
(1)元素周期表1-20号元素中,某两种元素的原子序数相差3,周期数相差1。
①这样的两种元素的组合有________种。
②若这样的两种元素形成的化合物中原子数之比为1∶1。
写出其中一种化合物的名称:_______________________;
(2)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在.从单质A起始发生的一系列化学反应可由下图表示:
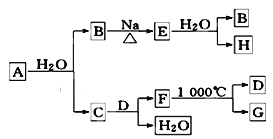
请回答下列问题:
①F的化学式为________,D的电子式为________________。
②E与水反应的化学方程式为___________________________________________;
③实际生产中,可由F为原料制备单质A,写出制备过程的化学方程式(不需考虑综合经济效益)_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。请回答下列问题:

(1)W在周期表中的位置是__________,Y、Z的离子半径由大到小的顺序为__________ (用元素符号表示)。
(2)下列说法正确的是__________。
a.XY2和WY2都能溶于水生成对应的酸
b.Q的含氧酸的酸性比X的含氧酸的酸性强
c.X的最简单气态氢化物的稳定性大于W的最简单气态氢化物的稳定性
d.由NaOH溶液分别滴入MgQ2、ZQ3溶液中的反应现象可比较Mg和Z金属性的强弱
(3)自来水厂常用QY2对饮用水进行消毒,处理后的水中要求QY2的浓度在0.10~0.80mg·L-1之间。碘量法可以检测水中QY2的浓度,步骤如下:
操作1:取一定体积的水样,加入一定量的碘化钾,再用NaOH溶液调至中性,并加入淀粉溶液,溶液变蓝。
操作II:再加入一定量的Na2S2O3溶液。(己知:2S2O32-+I2=S4O62-+2I-)
操作Ⅲ:然后再加硫酸调节水样pH至1~3。
操作时,不同pH环境中Q元素粒子种类及化合价如图所示:

①操作I中反应的离子方程式是___________________。
②确定操作Ⅱ完全反应的现象是_________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_________________。
④若水样的体积为1.0 L,在操作Ⅱ中消耗了 l.0×10-3mol·L-1的Na2S2O3溶液10 mL,则水样中QY2的浓度是_______ mg.L-1(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计和结论相对应的是
A. 将碘水倒入分液漏斗,加适量乙醇,振荡后静置分层,可将碘萃取到上层乙醇中
B. 某气体能使澄清石灰水变浑浊,该气体一定是CO2
C. 某无色溶液中滴加Ba(NO3)2溶液,产生白色沉淀,则原溶液中一定有SO42—
D. 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com