
【题目】X、Y 、Z、W是原子序数依次增大的短周期主族元素,其中Z的最外层电子数与X的核外电子总数相等。X、Z、W形成的一种化合物结构为![]() ,该物质常用于制备纳米材料以及工业催化剂。下列说法正确的是
,该物质常用于制备纳米材料以及工业催化剂。下列说法正确的是
A.元素非金属性:X>Y>Z
B.简单离子半径:Y<Z< W
C.工业上常通过电解W与Z形成的化合物制备W单质
D.简单气态氢化物的稳定性:X<Z
 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g) ![]() 2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到反应限度的是( )
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A. ②③⑥⑦ B. ①④⑧
C. 只有①④ D. 只有⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1 = 1.1×10-5 ,Ka2 = 1.3×10-8。下列叙述正确的是( )
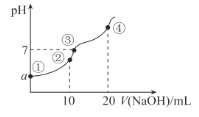
A.从点①到点④过程中水的电离程度先增大后减小
B.点②处c(Na+) + 2c(H+) + c(H2X) =2 c(X2-) + c(HX-) + 2c(OH-)
C.a近似等于3
D.点④处c(Na+) = 2 c(X2-) > c(OH-) > c(HX-) > c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙烯醇具有亲水性和成膜性,在适宜的浓度下,能起类似人工泪液的作用,作为润滑剂预防或治疗眼部刺激症状。聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)“洗衣凝珠”是由一层薄膜包裹洗衣液制成的新型洗涤产品,该薄膜的主要化学成分是可溶于水的聚乙烯醇(简称PVA)塑料,聚乙烯醇的化学式为(C2H4O)n,试回答:聚乙烯醇属于_____(填“金属材料”、“有机合成材料”、“硅酸盐材料”、“复合材料”之一),从物质结构的角度解释聚乙烯醇具有亲水性的原因___________________________。
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。
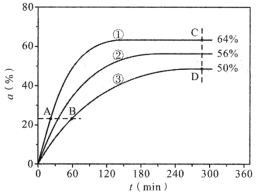
该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。A、B、C、D四点中,v逆最大的是___,v正最大的是____。
(4)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.提高乙酸甲酯的平衡转化率
c.提高了醇解反应的活化能 d.使k正和k逆增大相同倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年2月27日,科技日报报道中科院大连化学物理研究所创新性地提出锌碘单液流电池的概念,锌碘单液流电池中电解液的利用率达到近100% ,进而大幅度提高了电池的能量密度,工作原理如图所示。下列说法正确的是
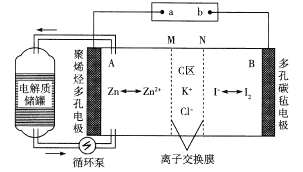
A.该电池放电时电路中电流方向为A→a→b→B→A
B.M为阴离子交换膜,N为阳离子交换膜
C.如果使用铅蓄电池进行充电,则B电极应与铅蓄电池中的Pb电极相连
D.若充电时C区增加的离子数为2NA,则A极增重65 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )
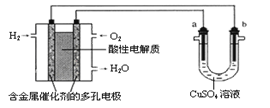
A. 燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________,中心原子的杂化方式为__________________。
(2)As4O6的分子结构如图所示,其中As原子的杂化方式为______________。

(3)AlH4-中,Al原子的轨道杂化方式为__________;列举与AlH4-空间构型相同的一种离子和一种分子:__________、__________(填化学式)。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为____________,SnBr2分子中Br-Sn-Br的键角________120°(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在家中进行化学实验,按照图A连接好线路发现灯泡不亮,按照图B连接好线路发现灯泡亮.
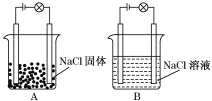
依据上述现象判断或回答下列问题:
(1)NaCl属于________(“酸”、“碱”或“盐”),因为__________________________.
(2)NaCl固体________(填“能”或“不能”)导电,原因是_____________________.
(3)NaCl溶液________(填“能”或“不能”)导电,原因是__________________.
(4)在NaCl固体、NaCl溶液中属于电解质的是_________________________________,
原因是____________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com