

分析 (1)CO2(g)+CH4(g)═2CO(g)+2H2(g)△H═+247.3kJ/mol ①
CH4(g)═C(s)+2H2 (g)△H═+75kJ/mol②
将方程式②-①得2CO(g)?C(s)+CO2(g)△H═(+75kJ/mol)-(+247.3kJ/mol )=-172.3kJ/mol,
该反应的△H<0、△S<0,如果△H-T△S<0就能自发进行;
(2)①相同压强下,升高温度CO转化率降低,平衡逆向移动;
该反应前后气体计量数之和减小,增大压强CO转化率增大;
200℃时,CO的转化率为0.5,所以平衡时CO、H2、CH3OH的浓度分别为0.25bmol/L、0.5bmol/L、0.25bmol/L,根据平衡常数的定义计算平衡常数;
②若200℃时,上述反应经过tmin达到平衡,氢气转化的溶液为6mol/L,根据v=$\frac{△c}{△t}$计算;
(3)甲烷和空气为原料,构成碱性燃料电池,负极上甲烷失电子生成碳酸根离子,据此书写电极反应式;
(4)根据装置图,阳极上铝失电子生成铝离子,铝离子和碳酸氢根离子发生双水解反应;
(5)根据Ksp[Al( OH)3]=c(Al3+)•c3(OH-)可计算出氢氧根离子的浓度,进而确定溶液的pH值.
解答 解:(1)已知:①CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=+247.3kJ•mol-1
②CH4(g)?C(s)+2H2(g)△H=+75kJ•mol-1,根据盖斯定很,将②-①得反应2CO(g)?C(s)+CO2(g)△H=-172.3kJ•mol-1,△H<0,而该反应△S<0,所以该反应在温度较低的条件下可以自发进行,
故答案为:该反应中△H<0,△S<0,在温度较低的条件下可以自发进行;
(2)①根据图可知,温度越高,CO的转化率越小,所以该反应的正反应为放热反应,根据图相同温度时P2的CO的转化率大于P1,而该反应为气体体积减小的反应,压强越大,CO的转化率越高,所以P1<P2,200℃时,CO的转化率为0.5,所以平衡时CO、H2、CH3OH的浓度分别为0.25bmol/L、0.5bmol/L、0.25bmol/L,所以平衡常数K=$\frac{0.25b}{0.25b×(0.5b)^{2}}$=$\frac{4}{{b}^{2}}$,
故答案为:放;<;$\frac{4}{{b}^{2}}$;
②若200℃时,上述反应经过tmin达到平衡,氢气转化的浓度为0.5bmol/L,所以该时间段内氢气的平均反应速率为$\frac{0.5b}{t}$ mol/(L•min)=$\frac{b}{2t}$mol/(L•min),
故答案为:$\frac{b}{2t}$mol/(L•min);
(3)甲烷和空气为原料,构成碱性燃料电池,负极上甲烷失电子生成碳酸根离子,负极的电极反应式为:CH4-8e-+10OH-═CO32-+7H2O,
故答案为:CH4-8e-+10OH-═CO32-+7H2O;
(4)铝作阳极,阳极上电极反应式为Al=Al3++3e-;阳极上生成的铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以溶液变浑浊Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(5)根据Ksp[Al( OH)3]=c(Al3+)•c3(OH-)可知,c(OH-)=$\root{3}{\frac{8.0×1{0}^{-33}}{1.0×1{0}^{-6}}}$=2×10-9,所以c(H+)=5×10-6,pH值为6-lg5=5.3,
故答案为:5.3.
点评 本题考查了反应进行的方向、影响平衡移动的因素、反应速率的计算、原电池和电解池原理、溶液的pH值的计算等,为高频考点,明确化学平衡移动原理及各个电极上发生的电极反应是解本题关键,难点是铝离子和碳酸氢根离子发生双水解的反应,题目难度中等.


科目:高中化学 来源: 题型:选择题
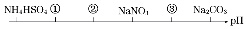 相同温度,相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分別为( )
相同温度,相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分別为( )| A. | NH4Cl、(NH4)2SO4、CH3COONa | B. | (NH4)2SO4、NH4Cl、CH3COONa | ||
| C. | (NH4)2SO4、NH4Cl、NaOH | D. | CH3COONa、NH4Cl、(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
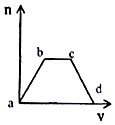 将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示:
将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量FeCl3溶液和过量 (填少量、过量)的KI溶液. | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至分液漏斗 (填仪器)中,倒入一定量的CCl4, 塞住活塞,充分振荡(萃取),静置. | 液体分层,上层接近无色,下层紫红色 |
| ③ | 打开活塞,先放出下层液体,再从分液漏斗的上口中倒出水层于试管中,加入KSCN溶液 | 出现血红色,则反应后的混合物中含Fe3+,进而证明这的确是一个可逆反应;反之则不含Fe3+,进而证明不是一个可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

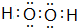 ,化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-
,化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向海水中加入明矾可以使海水淡化,用于解决淡水供应危机 | |
| B. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| C. | 将地沟油回收再加工为食用油,以减缓水体富营养化 | |
| D. | 用聚氯乙烯代替木材,生产包装盒、快餐盒等,以减少木材的使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com