
| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素在化合物中一定县正化合价 | |
| C. | 金属元素在不同化合物中化合价一定不同 | |
| D. | 金属元素的单质在常温下都是固体 |
分析 A、金属单质在反应中只能失去电子,亚铁离子既有氧化性又有还原性;
B、因金属元素在反应中失去电子,则化合价一定升高;
C、金属元素在不同化合物中化合价可以不相同,也可以相同;
D、汞在常温下为液态.
解答 解:A、金属单质在反应中只能失去电子,但处于中间价态的金属离子既有氧化性又有还原性,如亚铁离子既有氧化性又有还原性,故A错误;
B、金属元素在反应中失去电子,则化合价一定升高,所以金属元素在化合物中一定显正价,故B正确;
C、绝大数金属元素只有一种正价,则在不同化合物中化合价相同,故C错误;
D、汞在常温下为液态,故D错误;
故选B.
点评 本题考查金属元素的性质,熟悉常见的金属的原子结构和性质是解题的关键,难度不大.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
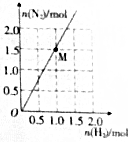 肼是一种优良的贮氢材料,在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示.若该反应中每转移1mol电子吸收30kJ热量,则图中M点时反应吸收的热量为( )
肼是一种优良的贮氢材料,在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量的关系如图所示.若该反应中每转移1mol电子吸收30kJ热量,则图中M点时反应吸收的热量为( )| A. | 120kJ | B. | 180kJ | C. | 240kJ | D. | 360kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2S只作还原剂 | |
| B. | 该反应是氧化还原反应 | |
| C. | S元素被还原 | |
| D. | 当1 mol O2参加反应时,共转移4 mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| B. | H216O、D216O、H218O、D218O互为同素异形体 | |
| C. | 明矾和漂白粉常用于自来水的净化或杀菌消毒,但两者的作用原理不同 | |
| D. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 硼原子以sp杂化 | |
| C. | 氯化硼晶体为分子晶体 | |
| D. | 氯化硼是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热煮沸的方法将硬水软化 | |
| B. | 图书、档案、贵重设备等失火时可以用二氧化碳灭火器灭火 | |
| C. | 包装食品使用的聚氯乙烯塑料袋,可以用加热的方法封口 | |
| D. | 炉具清洁剂中含有氢氧化钠能与油脂发生反应,可以用于去除油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液 蒸馏 萃取 | B. | 萃取 蒸馏 分液 | ||
| C. | 分液 萃取 蒸馏 | D. | 蒸馏 萃取 分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com