雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为______.
(2)上述反应中的氧化剂是______,反应产生的气体可用______吸收.
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O若生成2mol H3AsO4,则反应中转移电子的物质的量为______.若将该反应设计成一原电池,则NO2应该在______(填“正极”或“负极”)附近逸出.
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量______(选填编号).
a.小于0.5mol b.等于0.5mol c.大于0.5mol d.无法确定.
【答案】
分析:(1)根据反应物和生成物来分析反应,则利用氧化还原反应反应中得失电子守恒来分析完全反应的物质的量之比来解答;
(2)根据反应物中某元素化合价的降低来分析氧化剂,并利用气体的性质来分析气体的吸收;
(3)根据氧化还原反应中生成的H
3AsO
4的物质的量与转移电子数的关系来计算,利用原电池中正极发生还原反应,则某元素的化合价降低来解答;
(4)根据NO
2与11.2L O
2(混合后用水吸收全部转化成浓HNO
3,再利用碳与浓硝酸的反应来分析解答.
解答:解:(1)As
2S
3和SnCl
2在盐酸中反应转化为As
4S
4和SnCl
4并放出H
2S气体,则反应为2
 2
2S
3+2SnCl
2+4HCl=
 4
4S
4+2SnCl
4+2H
2S,
根据电子得失守恒知1molAs
2S
3作氧化剂得到2mol电子,而1molSnCl
2作还原剂失去2mol电子,则二者的物质的量之比是1:1,
故答案为:1:1;
(2)因As
2S
3在该反应中As元素的化合价降低,则As
2S
3为氧化剂,又H
2S是还原性气体可用碱液吸收或硫酸铜溶液吸收,
故答案为:As
2S
3;氢氧化钠溶液或硫酸铜溶液;
(3)由反应As
2S
3+10H
++10NO
3-=2H
3AsO
4+3S+10NO
2↑+2H
2O可知,As
2S
3作还原剂,转移电子数为2×(5-3)+3×(0+2)=10,
则生成2molH
3AsO
4时反应中转移电子的物质的量为10mol,又原电池中正极发生还原反应,则某元素的化合价降低,由反应可知N元素的
化合价由+5降低到+4,则NO
2属于还原产物,在正极生成,故答案为:10mol;正极;
(4)由NO
2与11.2LO
2混合后用水吸收全部转化成浓HNO
3,则4NO
2+O
2+2H
20═4HNO
3,氧气的物质的量为
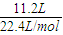
=0.5mol,
则由反应可知硝酸的物质的量为0.5mol×4=2mol,
若硝酸完全反应,则根据电子守恒可知生成CO
2的量是0.5mol×

=0.5mol,
但考虑到随着反应到进行,硝酸的浓度会降低而稀硝酸不与碳反应,则产生的CO
2的量小于0.5mol,故答案为:a.
点评:本题考查氧化还原反应中的有关计算,明确物质中元素的化合价、电子守恒、物质的性质是解答的关键,并注意化学反应的发生对物质浓度的要求来解答即可.

 2S3+2SnCl2+4HCl=
2S3+2SnCl2+4HCl= 4S4+2SnCl4+2H2S,
4S4+2SnCl4+2H2S,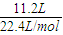 =0.5mol,
=0.5mol, =0.5mol,
=0.5mol,

 阅读快车系列答案
阅读快车系列答案
