
��1����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1 �� ��1275.6 kJ��mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2 �� ��566.0 kJ��mol
�� H2O(g) �� H2O(l) ��H3 �� ��44.0 kJ��mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
��2��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ����
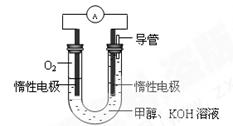
�������ͼ��ʾ�ĵ��װ�á��õ�ظ����ĵ缫��ӦΪ ��
�� ����һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�����ӷ���ʽΪ ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2012?����ģ�⣩��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϣ�
��2012?����ģ�⣩��Դ��ȱ���������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������˼״�����Ϊ21���͵�����ȼ�ϣ�| 3 |
| 2 |
| 3 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��2013?����һģ��Ŀǰ��ҵ����һ����CO2������ȼ�ϼ״��ķ��������Խ�CO2���Ϊ����
��2013?����һģ��Ŀǰ��ҵ����һ����CO2������ȼ�ϼ״��ķ��������Խ�CO2���Ϊ����| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ�����и���12���¿�У�����ϼ�⻯ѧ�Ծ��������棩 ���ͣ������
�״���һ�ֺܺõ�ȼ�ϣ���ҵ�Ͽ��ö���ԭ��ͨ����ͬ�ķ�Ӧ�Ƶü״���
��1����֪�ڳ��³�ѹ�£�

��2����ҵ�������о������������״�ȼ�ϵķ������÷�ӦΪ��

��ij�¶��£���6mol CO2��8molH2 �����ݻ�Ϊ2L���ܱ������У�8����ʱ��ƽ��״̬��H2��ת����Ϊ75%����ش�
����CH3OH��ʾ�÷�Ӧ��0-8min�ڵ�ƽ����Ӧ����v(CH3OH)=____��
�ڴ��¶��¸÷�Ӧƽ�ⳣ��K=____________ mol;
mol;
����������ƽ����ϵ�У��ٳ���2mol H2����Ӧ�ﵽƽ���H2��ת����____________75% ������ڡ�����С�ڡ����ڡ�����
��3��һ����̼������Ҳ���Ժϳɼ״���
�����÷�Ӧ�ں��º��������½��У�����˵����ȷ����____��
a�������������ܶȲ��ٸı䣬˵����Ӧ�Ѵﻯѧƽ��״̬
b����Ӧ�ﵽƽ���ͨ��CH3OH(g)ʹѹǿ����ƽ�������ƶ�
c����Ӧ�ﵽƽ���ͨ�����ʹѹǿ����ƽ�������ƶ�
d����Ӧ�ﵽƽ��������¶ȣ�ƽ�������ƶ���ƽ�ⳣ����С
e����ʹ�ô�������ı䷴Ӧ��;��������Ӧ�IJ���
��ij�¶��£���һ���ݻ�Ϊ2L���ܱ������н��и÷�Ӧ����֪���¶��µ�ƽ�ⳣ��K=50L2/mol2����Ӧ��ijʱ�̲�ø���ֵ����ʵ������£�

��Ƚϴ�ʱ�����淴Ӧ���ʵĴ�С�� ���>������<����=����
���>������<����=����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ�����и���3��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ������
Ŀǰ��ҵ����һ����CO2������ȼ�ϼ״��ķ��������Խ�CO2���Ϊ����
��1����֪�ڳ��³�ѹ�£�
��2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g) ��H= _1275.6 kJ��mol-1
��2CO(g)+ O2(g)= 2CO2(g) ��H= _556.0 kJ��mol-1
��H2O(l) = H2O(g) ��H=+ 44.0 kJ��mol-1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ ��
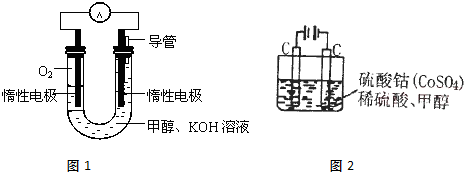
��2��ijͬѧ���ü״�ȼ�ϵ��Ϊ��Դ�������һ�ֵ�ⷨ��ȡFe(OH)2��ʵ��װ�ã���ͼ����ͨ�����Һ�в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ�����Դ��a��Ϊ �������������������缫��ӦʽΪ ��װ���϶�A���缫������ ���ѧʽ����B�缫�ϵĵ缫��ӦʽΪ ��

��3������ͬ����CO(g)��H2O(g)�ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO(g) +H2O(g) CO2(g) + H2(g)���õ������������ݣ�
CO2(g) + H2(g)���õ������������ݣ�
|
ʵ���� |
�¶�/�� |
��ʼ��/mol |
ƽ����/mol |
�ﵽƽ������ʱ��/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
�ٸ÷�Ӧ������ӦΪ ��������š����ȷ�Ӧ��
��ʵ��1�У���v(H2)��ʾ��ƽ����Ӧ����Ϊ ��
��900��ʱ����CO(g)��H2O(g)��CO2(g) �� H2(g)�����ʵ����ֱ���0.8mol��1.0mol��0.6 mol��0.8 mol�ֱ��������������ʱ��Ӧ��v(��) v(��)�������������������֮һ����
��ʵ��3��ʵ��2��ȣ��ı������������ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com