
(1)写出下列工业生产过程所涉及的主要化学方程式:
①用铝热法炼铁________
②电解法冶炼铝________
③湿法炼铜________
(2)海水中含有氯化镁,是镁的重要来源之一.从海水中制取镁,某同学设计了如下步骤:
①把贝壳制成石灰乳
②直接往海水中加石灰乳,沉降、过滤、洗涤沉淀物
③将沉淀物与盐酸反应,结晶、过滤、干燥产物
④将得到的产物熔融后电解.
下列说法不正确的是________(填代号)
A、此法的优点之一是原料来源丰富
B、进行①②③步骤的目的是从海水中提取氯化镁
C、第④步电解制镁是由于镁是很活泼的金属
D、以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
步骤②不够合理,理由是________.
科目:高中化学 来源: 题型:
请填空:
(1)写出A、B、C、D对应的元素符号:A._________、B._________、C._________、D._________。
(2)写出工业生产中BD3与氧气反应的化学方程式:__________________________。
(3)你认为B、C、D元素形成的化合物之间_________(填“能”或“不能”)发生下面的反应BC+BD3![]() DBC2+D
DBC2+D
(4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:![]()
Ⅱ.若维持温度不变,在一个与Ⅰ反应前的起始体积相同容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a_________b(填“>”“<”“=”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省八校高三第一次联考(12月)理综化学试卷(解析版) 题型:填空题
琉酸是无机“三大强酸"之一,其产量是衡量一个国家无机化工发展水平的重要标志。工业制硫酸的工艺流程如下图:

据图回答下列问题:
(1)写出用黄铁矿(主要含FeS2)造气的化学反应方程式________。
(2) 给出A、B物质的名称:A________, B________
(3) 催化氧化之前对SO2和空气的混合气体进行净化、干燥的目的是________ 选用B进入吸收塔吸收SO3的优点是________。
(4) SO2的催化氧化是一个可逆反应,采取适宜的反应条件有利于生产的进行。实际生产中,下列哪些生产条件或措施考虑到了平衡移动原理________ (选填序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.催化反应室中选择400-5000C温度
D.净化后的炉气中要有过量的空气
E. 催化氧化在常压下进行
F. 将尾气中的SO2循环利用
(5) 某硫酸厂每天消耗黄铁矿石(含FeS2质量分動60%) 20吨,生产的三阶段的转化率依次为98%、95%、98%,则该工厂一天能生产B的质量为__________吨。
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高一下学期期末考试化学试卷(解析版) 题型:填空题
已知A、B、C是第二周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC和BC以及AC2和BC2分子,D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子。请填空:
(1)写出A、B、C、D对应的元素符号:A________、B________、C________、D________。
(2)写出工业生产中BD3与氧气反应的化学方程式:
________________________________________________________________________。
(3)你认为B、C、D元素形成的化合物之间________(填“能”或“不能”)发生下面的反应BC+BD3―→DBC2+D2C,得出上面结论的理由是__________________________ _。
(4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:4AC(g)+2BC2(g)  4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
Ⅱ. 若维持温度不变,在一个与Ⅰ反应前的起始体积相同,容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a________b(填“>”“<”“=”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011年福建安溪一中、惠安一中、养正中学高二上学期期末联考化学卷 题型:填空题
(14分)
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2 2CO2+3H2O,制取二甲醚的反应如下:
2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g) CO2(g)+H2(g)
△H=-41.2kJ·mol-1
CO2(g)+H2(g)
△H=-41.2kJ·mol-1
CO(g)+2H2(g) CH3OH(g)
△H=-90.7kJ·mol-1
CH3OH(g)
△H=-90.7kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式: 。
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为 极,电极反应式为
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________________________________________
②生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
③下列哪个装置可防止铁棒被腐蚀_____________
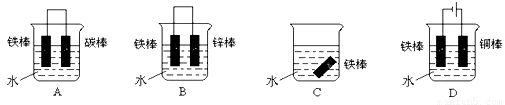
④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:
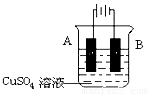
A电极对应的金属是 (写元素名称),
B电极的电极反应式是 ________________
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下(不需添加另外的反应物),经不同的化学反应,可实现如下图的各种变化。其中,反应①、②属于非氧化还原反应。正盐A分解得到三种气体。X、F和Y为单质,其余为化合物。在高科技领域中常用液态F制造低温环境。Y常用来制取漂白粉。
请填空:

(1)写出下列物质的化学式:
A F X 。
(2)反应⑤的阴极产物为 。
(3)写出实际工业生产中X+F→D具体的反应条件 。
(4)当B过量时,写出B与W反应的离子方程式 。
(5)当D过量时,写出D与Y的反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com