
| c(标注)×V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
| A、温度升高.Na2CO3溶液的Kw和c(OH一)均会增大 |
| B、沉淀转化的离子方程式为CO32-十CaSO4=CaCO3+SO42- |
| C、盐酸溶液中,CaCO3的溶解性大于CaSO4 |
| D、Na2CO3溶液遇CO2后,阴离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5mol |
| B、0.8mol |
| C、1.1mol |
| D、1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO3溶于水后能导电,故SO3为电解质 |
| B、强电解质的水溶液中不存在大量溶质分子 |
| C、向NaCN溶液中滴入酚酞试液显红色,则HCN为强酸 |
| D、25℃时,用CH3COOH溶液滴定等浓度NaOH溶液至pH=7,V(CH3COOH)<V(NaOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
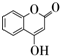 是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成
是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成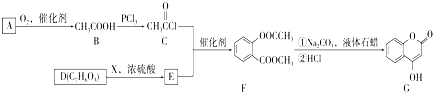
查看答案和解析>>
科目:高中化学 来源: 题型:
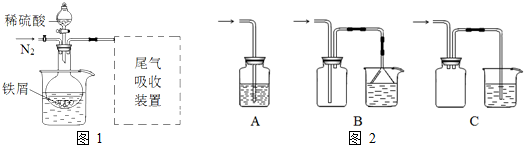
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 1.20 | 21.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X-、Y-、Z-、W-中Z-的还原性最强 |
| B、X2、Y2、Z2、W2中Z2的氧化性最弱 |
| C、2Z-+Y2═2Y-+Z2不能向右进行 |
| D、还原性X->Y- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com