
【题目】V、W、X、Y、Z五种短周期元素的原子序数依次增大,在周期表中W与V、X相邻,Y与Z相邻,X、Y同主族,Z的单质可由其化合物发生反应制得,反应的离子方程式为
![]()
(1)上述反应中方框内的物质或离子为 (填化学式或离子符号)。
(2)Y、Z两种元素的简单离子的半径大小为 (用离子符号表示,半径用r表示)
(3)五种元素的最简单氢化物中,沸点最高的是 (填分子式),V、W、Y、Z四种元素的最高价含氧酸中有一种性质与其他三种不同,该酸的分子式为 。
(4)在催化剂作用下由VY2与Z2反应制得VZ4,该反应的化学方程式为VY2+Z2=VZ4+Y2Z2(未配平)。①写出上述反应的化学方程式: 。
②在Y2Z2分子中,Y与Z原子均满足8电子稳定结构,则Y2Z2的电子式为 。
(5)化合物ZnFe2Xa可作为新型纳米材料,常温下可将工业废气中的氧化物分解而除去。
![]()
若1mol ZnFe2Xa与YX2反应可生成0.75 mol Y,则a= ;1 mol ZnFe2Xa可分解物质的量之比为3:2的WX2、WX的混合气体的体积V= L(标准状况下)。
(6)Q与X同主族,位于第四周期,其原子序数为________。
【答案】(1)Cl-(2)r(S2-)>r(Cl-)(3)H2O H2CO3(4)①CS2+3Cl2![]() CCl4+S2Cl2
CCl4+S2Cl2
②![]() (5)5/2 24 (6)34
(5)5/2 24 (6)34
【解析】试题分析:由题目所给信息可推断出:V为C元素,W为N元素,X为O元素,Y为S元素,Z为Cl元素。(1)在制取Z单质的反应中,Cl-与ClO3-发生归中反应生成Cl2,离子方程式为:5Cl-+ClO3-+ 6H+="3" Cl2+ 3H2O;(2)Y为S元素,Z为Cl元素,由于S2-和Cl-具有相同的核外电子排布,当核外电子排布相同时,核电荷数越大,半径越小,故半径:r(S2-)>r(Cl-);(3)由于H2O分子中有氢键,因此五种元素的最简单氢化物中,沸点最高的是H2O;C、N、S、Cl四种元素的最高价含氧酸中有一种性质与其他三种不同,该酸为H2CO3,原因是H2CO3为弱酸,而HNO3、H2SO4和HClO4为强酸;(4)①在催化剂作用下由CS2与Cl2反应制得CCl4,反应的化学方程式为:CS2+3Cl2![]() CCl4+S2Cl2;②在S2Cl2分子中,S与Cl原子均满足8电子稳定结构,则S2Cl2的电子式为:
CCl4+S2Cl2;②在S2Cl2分子中,S与Cl原子均满足8电子稳定结构,则S2Cl2的电子式为:![]() ;(5)若1mol ZnFe2Oa与SO2反应可生成0.75 mol S,S元素化合价由+4价降为0价,因此得电子的物质的量为
;(5)若1mol ZnFe2Oa与SO2反应可生成0.75 mol S,S元素化合价由+4价降为0价,因此得电子的物质的量为![]() ;在ZnFe2Oa中Fe元素化合价为+(a-1),ZnFe2O4中Fe元素的化合价为+3价,化合价升高,故失去电子的物质的量为:
;在ZnFe2Oa中Fe元素化合价为+(a-1),ZnFe2O4中Fe元素的化合价为+3价,化合价升高,故失去电子的物质的量为:![]() ,根据得失电子守恒可知,
,根据得失电子守恒可知,![]() ,故
,故![]() ;设NO2、NO的物质的量分别为3x、2x,由于Fe元素化合价升高,则氮元素化合价降低,即NO2、NO均被还原为N2,则根据得失电子守恒可知:
;设NO2、NO的物质的量分别为3x、2x,由于Fe元素化合价升高,则氮元素化合价降低,即NO2、NO均被还原为N2,则根据得失电子守恒可知:![]() ,解得:
,解得:![]() ,则标准状况下,混合气体的总体积
,则标准状况下,混合气体的总体积![]() (6)Q与O元素同主族,且Q位于第四周期,则Q为Se,原子序数为34。
(6)Q与O元素同主族,且Q位于第四周期,则Q为Se,原子序数为34。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.常温下.NH4Cl溶液加水稀释,![]() 增大
增大
B.0.1mol/LNa2CO3溶液加热后,溶液的pH减小
C室温下稀释0.1mol/LCH3COOH溶液,溶液的导电能力减弱,因此溶液中所有离子浓度均减小
D.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进Fe3+水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是石蕊溶液、稀硫酸、碳酸钠溶液、澄清石灰水中的一种,若用四个圆表示四种溶液,两圆相交部分为两溶液混合后出现的主要实验现象,如下图所示.请回答:
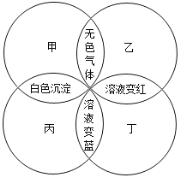
(1)丁是_________;通常其用途为_________。
(2)甲和丙的化学反应方程式为_________; 反应类型为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.我国目前使用的主要能源是化石能源
B.氢能源的优点有:热量值高、对环境友好
C.核能发电是解决能源危机的最佳途径
D.太阳能的缺点有:能量密度低、稳定性差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.甲烷的燃烧热H=-890.3KJ
B.炭生成一氧化碳的燃烧热是111KJ/mol
C.中和热H=-57.3KJ/mol
D.醋酸与NaOH反应的中和热小于-57.3KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“脑黄金”是一种不饱和程度很高的脂肪酸,它的分子中含有六个碳碳双键,学名二十六碳六烯酸,它的分子组成应是
A. C25H51COOH B. C25H39COOH C. C26H41COOH D. C26H47COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.下列说法错误的是 ( )
A. 2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为2:1
B. 4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2
C. 3I2+6KOH![]() 5KI+KIO3+3H2O中,被氧化和被还原的碘元素物质的量之比为1:5
5KI+KIO3+3H2O中,被氧化和被还原的碘元素物质的量之比为1:5
D. 2FeS+6H2SO4(浓)![]() Fe2(SO4)3+3SO2+2S↓+6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为2:3
Fe2(SO4)3+3SO2+2S↓+6H2O中,反应中发生氧化反应和发生还原反应的硫元素物质的量之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 金刚石和石墨互为同素异构体,熔点和硬度都很高
B. 氕、氘、氚是氢元素的三种核素,质子数都为1
C. 乙醇和二甲醚(CH3—O—CH3)互为同系物
D. C4H10的一氯取代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
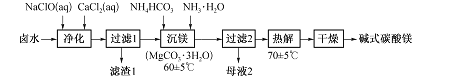
【题目】某课外活动小组用海水晒盐后的高浓度卤水制取碱式碳酸镁的工艺流程如下:
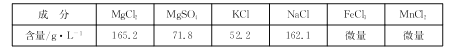
卤水(原料)的成分如下表:
回答下列问题:
(1)“净化”时,加入CaCl2溶液的作用是 ,Mn2+转化为MnO(OH)2沉淀的离子方程式为____。
(2)过滤时用到的玻璃仪器有烧杯、 、 ;滤渣1中的成分有MnO(OH)2、 (填化学式)。
(3)“沉镁”反应的离子方程式为 ,母液2中可提取的一种氮肥是 (填化学式),提取的方法是 。
(4)准确称取7.640 g所得碱式碳酸镁溶于足量盐酸中,收集到l 344 mL(标准状况下)气体;往所得溶液中加入足量NaOH溶液,过滤、洗涤、灼烧至质量不再变化,称量得固体3.200 g。该碱式碳酸镁的化学式为 ,MgCO3.3H2O热解生成碱式碳酸镁的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com