
| 选项 | 实验 | 现象 | 结论 |
| A | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 金属铁比铜活泼 |
| C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝滴落下来 | 金属铝的熔点较低 |
| D | 在相同条件下,分别加热Na2CO3固体和NaHCO3固体 | NaHCO3固体分解,产生气体使澄清石灰水变浑浊,Na2CO3固体并没有分解 | Na2CO3固体的稳定性比NaHCO3好 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.稀硝酸和过量Fe反应生成亚铁离子,亚铁离子和KSCN不反应;
B.铜和铁离子发生氧化还原反应生成亚铁离子和铜离子;
C.三氧化二铝的熔点高于铝的熔点,所以铝箔在酒精灯上加热到熔化,熔化的铝并不滴落;
D.NaHCO3固体受热易分解.
解答 解:A.过量铁粉,反应生成亚铁离子,加入KSCN溶液、溶液不显红色,故A错误;
B.Cu和Fe3+发生氧化还原反应,反应方程式为Cu+2Fe3+=Cu2++2Fe2+,所以没有黑色沉淀生成,溶液由黄色变为蓝色,故B错误;
C.将铝箔用坩埚钳夹住放在酒精灯火焰上加热,铝和氧气反应生成了氧化铝,形成氧化膜,三氧化二铝的熔点高于铝的熔点,包住了熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落,故C错误;
D.NaHCO3固体受热易分解,碳酸钠受热不分解,可证明,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子检验以及物质的性质,侧重物质性质及反应原理的考查,注意方案的合理性、评价性分析,易错选项是C.


科目:高中化学 来源: 题型:选择题
| A. | 向盛水的烧杯中投入小拇指头大小的钠块,观察现象 | |
| B. | 将一小块钠放在石棉网上加热,观察现象 | |
| C. | 实验后剩余的钠不能放回原瓶 | |
| D. | 用手掰开一块金属钠,观察钠的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 A、B是两种有刺激性气味的气体,其水溶液都有漂白性,且当两者等物质的量通入到有色物质的溶液中时失去漂白性.试根据下列实验事实填空
A、B是两种有刺激性气味的气体,其水溶液都有漂白性,且当两者等物质的量通入到有色物质的溶液中时失去漂白性.试根据下列实验事实填空查看答案和解析>>
科目:高中化学 来源: 题型:选择题
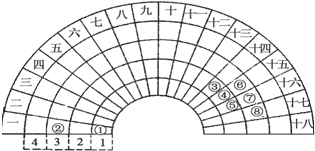
| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 | |
| C. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| D. | ②⑤⑦三种元素形成的盐溶液在25℃时的pH值为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
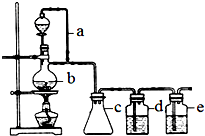 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中可能大量存在Fe2+、Cl?、NO3?、Na+ | |
| B. | 无色溶液中可能大量存在Mg2+、NH4+、Cl?、SO42- | |
| C. | 强碱性溶液中可能大量存在NH4+、K+、Cl?、SO42? | |
| D. | 酸性溶液中可能大量存在Fe3+、K+、I?、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
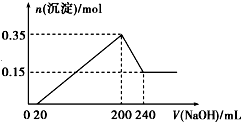
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤代反应 | B. | 加聚反应 | C. | 酯化反应 | D. | 消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com