
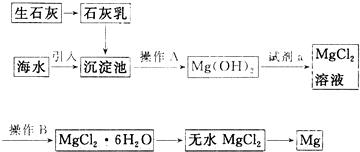
分析 海水提镁的主要流程分析可知,生石灰和水反应生成石灰乳,海水引入沉淀池加入石灰乳,利用氢氧化钙沉淀镁离子生成氢氧化镁沉淀,过滤得到氢氧化镁沉淀,加入盐酸溶液溶解得到氯化镁溶液,通过蒸发浓缩冷却结晶得到氯化镁晶体,在氯化氢气流中加热失水得到固体氯化镁,通电电解氯化镁得到镁合氯气;
(1)根据镁离子能与氢氧根离子反应生成沉淀来确定氢氧化钙的作用;
(2)根据海洋产品中与石灰石相同的物质进行解答;
(3)根据过滤的原理和六水合氯化镁晶体的特点解答;
(4)根据反应流程图前后推解;
(5)根据电解的原理解答,根据流程图推测副产物氯气的用途;
解答 解:(1)镁离子能与氢氧根离子反应生成氢氧化镁沉淀:Mg2++Ca(OH)2═Mg(OH)2+Ca2+,写离子方程式时氢氧化镁沉淀写化学式,
故答案为:沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀);Mg2++Ca(OH)2═Mg(OH)2+Ca2+;
(2)贝壳或牡蛎壳的主要成分为碳酸钙,故答案为:贝壳(或牡蛎壳等);
(3)分离不溶于水的固体和液体,可用过滤的方法,从沉淀池中得到氢氧化镁用过滤的方法,从氯化镁溶液中得到六水合氯化镁,防结晶水损失,通过加热浓缩或蒸发结晶的方法获得六水合氯化镁,
故答案为:过滤; 加热浓缩(或蒸发结晶);
(4)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,加入的足量试剂a是HCl,
故答案为:HCl;
(5)无水MgCl2在熔融状态下,通电后阳极氯离子失去电子生成氯气,阴极镁离子得到电子生成镁单质,所以氯化镁电解会产生Mg和Cl2,副产物氯气和氢气反应生成氯化氢,能循环使用,
故答案为:MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;制盐酸,循环使用;
点评 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖溶液与新制的Cu(OH)2悬浊液混合加热 | |
| B. | 木板上涂抹浓硫酸 | |
| C. | 淀粉溶液中加入碘酒 | |
| D. | 苯加入到酸性高锰酸钾溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  根据图可判断正反应的△H<0 | |
| B. |  根据图,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 | |
| C. | 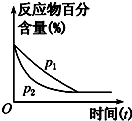 图可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响 | |
| D. |  图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基与氢氧根有相同的化学式和电子式 | |
| B. | 乙醇的官能团是-OH,乙醇是含-OH的化合物 | |
| C. | 常温下,1mol乙醇可与足量的Na反应生成11.2LH2 | |
| D. | 由工业酒精获得无水乙醇的方法是直接加热蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时生成 xmolNH3,则反应达到平衡状态 | |
| C. | 达化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若反应发生在体积恒定的密闭容器中,当密度不变时,化学反应达到平衡状态 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com