
下列实验操作能达到目的的是
实验目的 | 实验操作 | |
A | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
B | 配制氯化铁溶液 | 将氯化铁溶解在较浓的盐酸中再加水稀释 |
C | 确定Na2SO3样品是否部分被 氧化 | 取样于试管中,加入稀硝酸酸化,再滴加BaCl2溶液,观察是否有白色沉淀生成 |
D | 检验乙醇发生消去反应生成 乙烯 | 将生成的气体直接通入盛有酸性高锰酸钾溶液的试剂瓶,观察溶液是否褪色 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
下列晶体中,化学键种类相同,晶体类型也相同的是
A.SO2与SiO2 B.CO2与H2O C.NaCl与HCl D.CCl4与KCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.碳酸钠溶液与盐酸反应:Na2CO3+2H+=2Na++CO2↑+H2O
C.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=AlO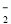 +2H2O
+2H2O
D.稀硫酸和氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
1g N2中含有x个原子,则阿伏加德罗常数是
A.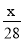 mol-1 B.14x mol-1 C.
mol-1 B.14x mol-1 C.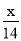 mol-1 D.28x mol-1
mol-1 D.28x mol-1
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:填空题
我国铜矿资源分布广泛,已探明储量居世界第三位。铜元素常见价态为+1,+2。大多数+1价铜的化合物是难溶物,如:CuCl、Cu2O等。+1价铜在酸性条件下易发生反应:2Cu+= Cu2++Cu。
(1)CuCl通常用作催化剂、杀菌剂、媒染剂、脱色剂。某实验兴趣小组模拟制备CuCl。
方法一:在CuCl2溶液中逐滴加入KI溶液可能发生:2Cu2++2Cl-+2I-=2CuCl↓(白色)+I2,为顺利观察到白色沉淀可以加入的最佳试剂是 。
A.SO2 B.苯 C.NaOH溶液 D.乙醇
方法二:将Na2SO3溶液逐滴加入CuCl2溶液中再加入少量的浓盐酸混匀,倾出清液,过滤出沉淀,沉淀用无水乙醇多次洗涤,得白色粉末状固体。
①沉淀的过滤和洗涤均用到的玻璃仪器有 ;
②洗涤CuCl沉淀的操作为 。
(2)纳米级Cu2O具有特殊的光学、电学及光电化学性质,研究制备纳米氧化亚铜的方法成为当前的研究热点之一。
方法一:在新制Cu(OH)2浊液中滴入N2H4•H2O水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。写出上述制备过程中的化学反应方程式 ;
方法二:以铜作阳极,石墨作阴极,电解含有NaOH的NaCl水溶液。
已知:该电解过程中阳极先生成难溶物CuCl,再与NaOH反应转化为Cu2O。
①写出阳极的电极反应式 ;
②电解后溶液中c(OH-)会 (填“变大”、“变小”或“不变”);
③若电解电路中通过0.2 mol电子,理论上生成Cu2O的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三模拟一化学试卷(解析版) 题型:实验题
[化学—选修5:有机化学基础]对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(图中B1和B2、C1和C2分别互为同分异构体,无机产物略去):
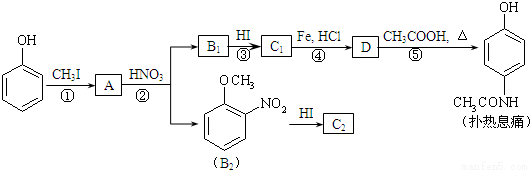
已知: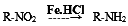 ,请按要求填空:
,请按要求填空:
(1)写出A分子中官能团名称:_________;C1的结构简式为:___________________。
(2)写出由D生成扑热息痛的化学方程式:_______________________。
(3)学出反应③和④的反应类型:③______________,④__________。
(4)工业上设计反应①、②、③,而不是只通过反应②得到C1、C2,其目的是:___________。
(5)扑热息痛有很多同分异构体,符合下列要求的同分异构体有5种:(1)是对位二取代苯;(II)苯环上两个取代基一个含氮不含碳、另一个含碳不含氮;(III)两个氧原子与同一原子相连。其中2种的结构简式是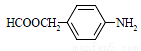 和
和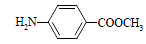 ,写出另3种同分异构体的结构简式____________、____________、____________。
,写出另3种同分异构体的结构简式____________、____________、____________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三模拟一化学试卷(解析版) 题型:选择题
某太阳能电池的工作原理如图所示。下列说法正确的是
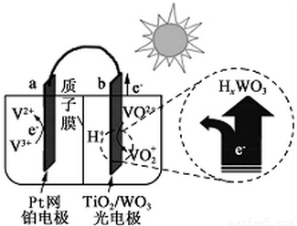
A.光照时,b极的电极反应式为VO2+-e-+H2O=VO2++2H+
B.光照时,毎转移2mol电子,有2mol H+由a极区经质子交换膜向b极区迁移
C.夜间,a极的电极反应式为V3++e-=V2+
D.硅太阳能电池供电原理与该电池相同
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三上质检二化学卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的4种短周期元素.X与Z位于同一主族,X原子的最外层电子数是次外层电子数的2倍,Y元素的单质既能与盐酸反应又能与NaOH溶液反应,X、Y、Z、W原子的最外层电子数之和为18.下列说法不正确的是
A. X单质在一定条件下能与Z的最高价氧化物发生置换反应
B. 原子半径:Y>Z>W
C. 最高价氧化物对应水化物的酸性由弱到强的顺序:X<Z<W
D. 室温下,0.1mol/LW的气态氢化物的水溶液的pH=1
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:填空题
硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)===BaS(s)+4CO(g) ΔH=+571.2 kJ·mol-1
BaS(s)===Ba(s)+S(s) ΔH=+460 kJ·mol-1
已知:2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
则:Ba(s)+S(s)+2O2(g)===BaSO4(s) ΔH=________。
Ⅱ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法
反应原理:恒温恒容时2C(s)+2SO2(g) S2(g)+2CO2(g)。
S2(g)+2CO2(g)。
反应进行到不同时间测得各物质的浓度部分图像如图:
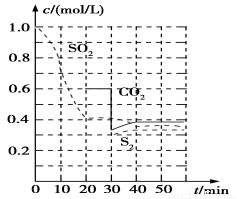
①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是________(填序号)。
a.c(Na+)+c(H+)>c(SO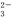 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
b.水电离出c(H+)=1×10-8 mol/L
c.c(Na+)>c(HSO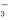 )>c(H+)>c(SO
)>c(H+)>c(SO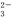 )
)
(3)电化学处理法
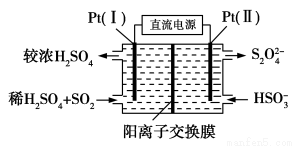
①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com