
| 元素编号 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高正价 | +6 | +1 | 无 | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低负价 | -2 | 无 | -2 | 无 | -4 | -3 | -1 | 无 | -3 | -4 |
分析 前20号元素中,AC都有最低价-2,处于VIA族,A有+6价,C只有-2价,则A为S元素、C为O元素;E、J都有+4、-4价,处于IVA族,E的原子半径较小,则E是C元素、J是Si;F、I都有+5、-3价,处于VA族,F的原子半径大于I,则F是P元素、I是N元素;G有+7、-1价,为ⅦA族元素,G是Cl元素;D只有+3价,为ⅢA族元素,原子半径大于Si原子半径,所以D是Al元素;B、H最高正价为+1,没有负价,处于IA族,B的原子半径比Al原子半径大很多,不能处于同周期,则B为K元素,B、H原子半径相差不是太大,应相邻,则H为Na,
(1)同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能减小;
(2)碳与浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫和水;
(3)比元素B原子序数大11的元素为Zn,写出锌的基态原子电子排布式;
(4)有氧元素的非金属性大于氮元素,可以根据电负性、对应气态氢化物的稳定性判断非金属性强弱;氧元素没有最高正价,不能根据含氧酸及最高正价判断其非金属性.
解答 解:前20号元素中,AC都有最低价-2,处于VIA族,A有+6价,C只有-2价,则A为S元素、C为O元素;E、J都有+4、-4价,处于IVA族,E的原子半径较小,则E是C元素、J是Si;F、I都有+5、-3价,处于VA族,F的原子半径大于I,则F是P元素、I是N元素;G有+7、-1价,为ⅦA族元素,G是Cl元素;D只有+3价,为ⅢA族元素,原子半径大于Si原子半径,所以D是Al元素;B、H最高正价为+1,没有负价,处于IA族,B的原子半径比Al原子半径大很多,不能处于同周期,则B为K元素,B、H原子半径相差不是太大,应相邻,则H为Na.
(1)同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能减小,故上述元素中K元素的第一电离能最小,
故答案为:K;
(2)E的单质为碳,I元素的最高价氧化物对应的水化物为硫酸,碳与浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)B为K元素,比B的原子序数大11的元素的原子序数为30,为Zn元素,其基态原子电子排布式是:[Ar]3d104s2,
故答案为:[Ar]3d104s2;
(4)C是O元素、I是N元素,为同周期元素,从左到右元素的非金属性逐渐增强,则非金属性O的较强;
a.非金属性越强,氢化物越稳定,故a正确;
b.电负性越大,对键合电子吸引力越大,元素非金属性越强,故b正确;
c.氧元素没有含氧酸,不能比较最高价含氧酸的酸性判断非金属性强弱,故c错误;
d.氧元素没有最高化合价,无法根据最高化合价判断其非金属性,故d错误;
故答案为:N;ab.
点评 本题考查了元素周期律和元素周期律的应用,题目难度中等,正确推断各元素为解答关键,注意熟练掌握元素周期表结构、元素周期律内容,试题培养了学生的分析能力及灵活应用能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
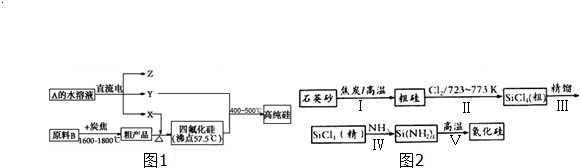
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、AlO2- | B. | Na+、SO32-、Cl-、K+ | ||
| C. | Na+、NH4+、SO42-、Cl- | D. | K+、I-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
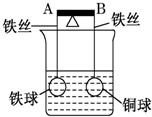 如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球.调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)
如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球.调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去KCl中混有的KI:溶于水通入过量氯气,蒸发结晶 | |
| B. | 除去BaSO4固体中混有的BaCO3:加过量盐酸后,过滤 | |
| C. | 除去Na2CO3固体中的NaHCO3:加热至恒重 | |
| D. | 除去CuO中混有的Al2O3:加过量盐酸后,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
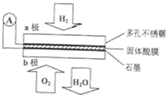 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1 mol电子,标准状况下需消耗1.12L的H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成1 mol SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗 1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 反应后物质中可能有白色固体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
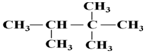 :2,2,3-三甲基丁烷;
:2,2,3-三甲基丁烷;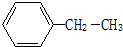 乙苯
乙苯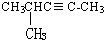 4-甲基-2-戊炔.
4-甲基-2-戊炔.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com