
 ����β���е���Ҫ��Ⱦ����NO��CO��Ϊ�˼��������Ⱦ���������ͨ�����·�Ӧ����������β����
����β���е���Ҫ��Ⱦ����NO��CO��Ϊ�˼��������Ⱦ���������ͨ�����·�Ӧ����������β����| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C��NO��10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
| C��CO��10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
| ʵ�� ��� | T/��C | NO��ʼŨ ��/10-3mol•L-1 | CO��ʼŨ ��/10-3mol•L-1 | �����ı� �����/m2•g-1 |
| �� | 350 | 1.20 | 5.80 | 124 |
| �� | 280 | 1.20 | 5.80 | 124 |
| �� | 280 | 1.20 | 5.80 | 82 |
���� ��1�����ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ŀ���Ȼ�ѧ����ʽ����Ӧ��Ҳ������Ӧ�ļ��㣻
��2�����ɱ������ݿ�֪4sʱ��Ӧ����ƽ�⣬1-3s��NOŨ�ȱ仯��Ϊ4.5��10-4 mol/L-1.5��10-4 mol/L=3��10-4 mol/L����2s��ƽ��ÿ���ڱ仯��Ϊ1.5��10-4 mol/L���淴Ӧ���У���Ӧ���ʼ�С����2s��ǰ1s��NOŨ�ȱ仯��Ӧ����1.5��10-4 mol/L����2sʱNO��Ũ��С��4.5��10-4 mol/L-1.5��10-4 mol/L=3��10-4 mol/L����2sʱNO��Ũ��Ӧ����1.5��10-4 mol/L��3��10-4 mol/L֮�䣻
�ڸ���v=$\frac{��c}{��t}$����v��NO��������������֮�ȵ����仯ѧ������֮�ȼ���v��CO2����
�ۿ��淴Ӧ����ƽ��ʱ��ͬһ���ʵ����淴Ӧ������ȣ�����ֵ�Ũ�ȡ��������䣬�ɴ�������һЩ���������䣬�ж�ƽ��״̬��������Ӧ�淴Ӧ���з����仯�������������ɱ仯�����仯��˵������ƽ�⣻
��3����ͼ��֪�����ߢ�����ߢ���ȣ�ƽ��û���ƶ�����Ӧ���ʢ�Ȣ�죬�����ߢ��д����ȱȱ�������ڢ�����������ͬ�������ߢ�����ߢ���ȣ���Ӧ���ʱ����ƽ�������ƶ����÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���
��4���ɵ���ת���غ㣬�ɵù�ϵʽCO��2Ag���ݴ˼���ƽ��ʱһ����̼��������ϻ�ѧƽ������ʽ�������ֵ����ʵ����������������Ϊ1L�������ʵ�������Ũ�ȼ���ƽ�ⳣ�������뻯ѧƽ�ⳣ������ʽK=$\frac{{c}^{2}��C{O}_{2}����c��{N}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$���㣻
��5����ȼ�ϵ���У������������õ��ӺͶ�����̼��Ӧ����̼������ӣ��ܵ缫��Ӧʽ��ȥ������Ӧʽ�ɵø����缫��Ӧʽ��
��� �⣺��1����֪����2 NO��g��+2CO��g��?2CO2��g��+N2��g����H=-746.5KJ/mol
��2C ��s��+O2��g��?2CO��g����H=-221.0KJ/mol
��C ��s��+O2��g��?CO2��g����H=-393.5KJ/mol
�����ݸ�˹���ɣ��ۡ�2-��-�ٵõ���N2��g��+O2��g��=2NO��g�� ���H=��-393.5KJ/mol����2-��-220KJ/mol��-��-746.5KJ/mol��=+180.5KJ/mol��
�ʴ�Ϊ��+180.5��
��2�����ɱ������ݿ�֪4sʱ��Ӧ����ƽ�⣬1-3s��NOŨ�ȱ仯��Ϊ4.5��10-4 mol/L-1.5��10-4 mol/L=3��10-4 mol/L����2s��ƽ��ÿ���ڱ仯��Ϊ1.5��10-4 mol/L���淴Ӧ���У���Ӧ���ʼ�С����2s��ǰ1s��NOŨ�ȱ仯��Ӧ����1.5��10-4 mol/L����2sʱNO��Ũ��С��4.5��10-4 mol/L-1.5��10-4 mol/L=3��10-4 mol/L����2sʱNO��Ũ��Ӧ����1.5��10-4 mol/L��3��10-4 mol/L֮�䣬ѡ����ֻ��2.5��10-4 mol/L���ϣ�
��ѡ��D��
��2s��NO��Ũ�ȱ仯��Ϊ10��10-4 mol/L-2.5��10-4 mol/L=7.5��10-4 mol/L����2s��v��NO��=$\frac{7.5��1{0}^{-4}mol/L}{2s}$=3.75��10-4 mol/��L��s��������֮�ȵ����仯ѧ������֮�ȣ���v��CO2��=v��NO��=3.75��10-4 mol/��L��s����
�ʴ�Ϊ��3.75��10-4 mol/��L��s����
��a����2v����CO��=v����N2��������֮�Ȳ����ڼ�����֮�ȣ���ӦΪ����ƽ�⣬��a����
b�������л��������ܶ�ʼ�ձ��ֲ��䣬�ܶȲ��䣬����˵����Ӧ����ƽ�⣬��b����
c���淴Ӧ���У�������������ʵ������У������������ѹǿ��С�������������ѹǿ���䣬˵������ƽ�⣬��c��ȷ��
d��CO2������������䣬˵��������̼�������䣬��d��ȷ��
��ѡ��ab��
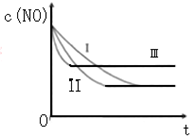
��3�����ڢڡ����¶���ͬ��������ƽ���ƶ���Ӱ�죬��ѧƽ�ⲻ�ƶ����ﵽ��ͬ��ƽ��״̬�����ڵ���ʼŨ�Ƚϴ����ıȱ�����ϴ���Ӧ�����ʴ����Ԣ��ȴﵽ��ѧƽ�⣻
���ڢ١���Ũ�ȡ������ı��������ͬ�����ٵ��¶Ƚϸߣ���Ӧ���ʽϿ죬�ȵ���ƽ�⣬��ƽ�����淴Ӧ�ƶ���ƽ��ʱNO��Ũ������
�������ߢ��Ӧʵ��ۣ����ߢ��Ӧʵ��ڣ����ߢ��Ӧʵ��٣�
�ʴ�Ϊ���ۢڢ٣�
��4����ƽ��ʱ���������CO�����ʵ���Ϊx����
CO��������2 Ag
1mol 2��108g
x 43.2g
��ã�x=$\frac{1mol��43.2g}{2��108g}$=0.2mol
2NO��g��+2CO��g��?2CO2��g��+N2��g��
��ʼ����mol����1 1 0 0
�仯����mol����0.8 0.8 0.8 0.4
ƽ������mol����0.2 0.2 0.8 0.4
�����������Ϊ1L���������ʵ�������Ũ�ȼ���ƽ�ⳣ������ƽ�ⳣ��K=$\frac{{c}^{2}��C{O}_{2}����c��{N}_{2}��}{{c}^{2}��NO����{c}^{2}��CO��}$=$\frac{0��{8}^{2}��0.4}{0��{2}^{2}��0��{2}^{2}}$=160��
�ʴ�Ϊ��160��
��5����������ȼ�ϵ���У������������õ��ӺͶ�����̼��Ӧ����̼������ӣ��缫��ӦʽΪ��O2+2CO2+4e-�T2 CO32-������ܷ�Ӧ����ʽΪ2CO+O2=2CO2����ȥ������Ӧʽ�ɵø����缫��ӦʽΪ��2CO+2CO32--4e-�T4CO2��
�ʴ�Ϊ��2CO+2CO32--4e-�T4CO2��
���� ����Ƚ��ۺϣ�����ƴ������Ŀ���漰�Ȼ�ѧ����ʽ��д����ѧ��Ӧ���ʼ�����Ӱ�����ء���ѧƽ��״̬�жϡ���ѧƽ��ͼ��ƽ�ⳣ�����㡢ԭ��ص缫��Ӧʽ��д�ȣ��Ƕ�ѧ���ۺ������Ŀ��飬��2���Т�Ϊ�״��㣬ѧ��������Ũ�ȼ�Сȷ�����䣬���Է�Ӧ�������⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
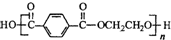 �����ò����Ǵ���ë�ߣ��������й�˵������ȷ���ǣ�������
�����ò����Ǵ���ë�ߣ��������й�˵������ȷ���ǣ�������| A�� | ��ë����Ҫ�ɷ����ڵ����� | |
| B�� | ����������Ȼ�߷��ӻ����� | |
| C�� | �ϳɵ��ڵĵ���֮һ������HOCH2CH2OH | |
| D�� | �������յķ���������ë�͵��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
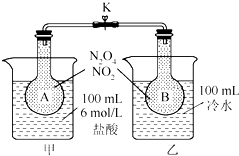 ��ͼ��ʾ����ƿA��B��װ����ͬŨ�ȵ�NO2��N2O4�Ļ�����壬�м�ֹˮ��K�н����ձ�����ʢ��100mL 6mol/L��HCl����Һ�з���25gNaOH���壬ͬʱ���ձ����з���25g NH4NO3���壬����ʹ֮�ܽ⣮
��ͼ��ʾ����ƿA��B��װ����ͬŨ�ȵ�NO2��N2O4�Ļ�����壬�м�ֹˮ��K�н����ձ�����ʢ��100mL 6mol/L��HCl����Һ�з���25gNaOH���壬ͬʱ���ձ����з���25g NH4NO3���壬����ʹ֮�ܽ⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
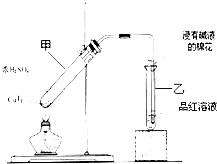 ij��ʦ�ڿ���������ͼ��ʾ��װ������֤Ũ������ͭ�Ƿ�����Ӧ����̽�ַ�Ӧ��������������ʣ���ش��������⣺
ij��ʦ�ڿ���������ͼ��ʾ��װ������֤Ũ������ͭ�Ƿ�����Ӧ����̽�ַ�Ӧ��������������ʣ���ش��������⣺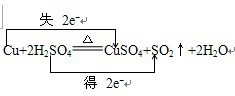 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʱ��/s | 0 | 50 | 100 | 150 |
| c��N2O5��/mol��L-1 | 2.50 | 1.76 | 1.25 | 1.25 |
| A�� | T1�¶��µ�ƽ�ⳣ��ΪK1��T2�¶��µ�ƽ�ⳣ��ΪK2����T1��T2����K1��K2 | |
| B�� | 50s��N2O5�ֽ�����Ϊ1.48��10-2mol��L-1��s-1 | |
| C�� | T1�¶��µ�ƽ�ⳣ��ΪK1=15.625��ƽ��ʱN2O5��ת����Ϊ50% | |
| D�� | �ﵽƽ������� �������䣬�����������ѹ����ԭ����$\frac{1}{2}$����c��N2O5����2.50mol��L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
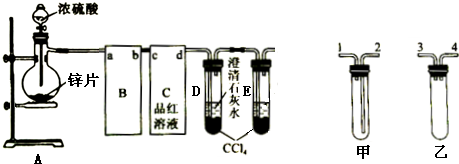
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʱ�䣨min�� Ũ�ȣ�mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 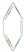 | B�� | C6H14 | C�� | 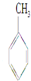 | D�� |  |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com