
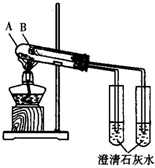
 研究Cl2、SO2、CO2、NH3等气体的性质对生产和生活与重要的意义.
研究Cl2、SO2、CO2、NH3等气体的性质对生产和生活与重要的意义.分析 (1)氨气催化氧化生成一氧化氮和水;
(2)①漂白粉制备是利用石灰乳氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水;
②氯气具有强氧化性能氧化溴离子为溴单质;
(3)①B加热温度较低,可将碳酸氢钠在较低温度下加热,不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定;
②等质量的碳酸钠和碳酸氢钠物质的量碳酸氢钠大,生成二氧化碳多;
(4)HClO的漂白性为永久性的,而二氧化硫的漂白为暂时性的.
解答 解:(1)工业上利用氨在催化剂存在的情况下与氧气反应来制备生产硝酸所需要的一氧化氮,氨气催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$ 4NO+6H2O,
故答案为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$ 4NO+6H2O;
(2)①漂白粉制备是利用石灰乳氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,
故答案为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
②氯气具有强氧化性能氧化溴离子为溴单质,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,
故答案为:2Br-+Cl2=Br2+2Cl-;
(3)①B加热温度较低,可将碳酸氢钠在较低温度下加热,不直接加热碳酸氢钠就能分解更说明碳酸氢钠不稳定,B中为NaHCO3,选B,
反应的化学方程式为:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑,
故答案为:B;2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ Na2CO3+H2O+CO2↑;
②等质量的碳酸钠和碳酸氢钠物质的量碳酸氢钠大,生成二氧化碳多,取等质量的碳酸钠与碳酸氢钠与足量盐酸反应产生CO2的量前者小于后者,
故答案为:<;
(4)因二氧化硫的漂白为暂时性,结合生成的无色物质不稳定,则实验方案为将褪色后的溶液加热,若重新恢复红色,则通入的气体是SO2;若仍为无色,则通入的气体是Cl2,
故答案为:分别取少量经漂白的品红溶液与试管中,加热,恢复红色的是经过SO2漂白的品红溶液,不能恢复红色的是经过氯气漂白的品红溶液.
点评 本题考查了碳酸钠和碳酸氢钠的性质,注意装置与物质性质的关系,明确碳酸钠和盐酸反应分两步进行为解答的关键,侧重二者与酸的反应及稳定性比较的考查,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 灼烧氯化铷时,火焰有特殊颜色 | |
| B. | 硝酸铷,不溶于水 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失 | |
| B. | ②红色褪去的原因是SO2将Fe3+还原为Fe2+ | |
| C. | ②红色褪去的原因是SO2将SCN-还原 | |
| D. | SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
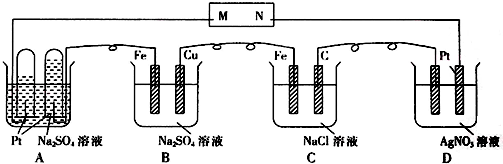
| A. | 只有⑤⑥ | B. | 只有③④⑤⑥ | C. | 全部 | D. | 除② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是含有碳元素的化合物都是有机化合物 | |
| B. | 油脂在人体中发生水解的产物是氨基酸 | |
| C. | 蛋白质主要由C、H、O、N四种元素组成 | |
| D. | 糖类物质都有甜味 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com