
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NH4HCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)
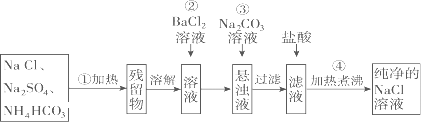
(1)操作②为什么不用硝酸钡溶液,其理由是_______________________________;
(2)进行操作②后,如何判断SO42-已除尽,方法是___________________________;
(3)操作③的目的是____________,其中涉及到的离子方程式是_______________;
(4)往滤液中加入盐酸的离子方程式是__________________________________;
(5)NH4HCO3在水溶液中的电离方程式_________________________________。
【答案】 会使溶液中引入新的杂质离子NO3-,在以后操作中无法除去 取上层清液加入BaCl2溶液,若无沉淀说明SO42-已除尽 除去过量的Ba2+ Ba2+ + CO32- = BaCO3↓ 2H+ + CO32- = CO2 +H2O↑ NH4HCO3 = NH4++HCO3-
【解析】本题考查物质的分离和提纯,(1)流程的是提纯NaCl,不能引入新杂质,因此操作②用BaCl2溶液,不能用Ba(NO3)2,否则会引入NO3-;(2)检验SO42-,常用Ba2+检验,产生白色沉淀,证明沉淀没有洗净,具体操作是取上层清液加入BaCl2溶液,若无沉淀说明SO42-已除尽;(3)操作②加入BaCl2是过量的,必须除去,因此操作③的目的是除去过量的Ba2+,其离子反应是Ba2++CO32-=BaCO3↓;(4)滤液中含有的离子是Na+、CO32-、Cl-,加入盐酸后发生的反应是CO32-+2H+=CO2↑+H2O;(5)NH4HCO3属于盐,且HCO3-属于弱酸酸式根,因此NH4HCO3电离方程式为NH4HCO3=NH4++HCO3-。


科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应,且生成物的总能量高于反应物的总能量的是
A. 铝热反应 B. 铝与盐酸反应
C. Ba(OH)2·8H2O晶体和NH4Cl晶体反应 D. 灼热的炭与CO2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学反应能量变化相关的叙述正确的是
A. 生成物总能量一定低于反应物总能量
B. 拆开物质中的化学键一定需要吸收能量
C. 应用盖斯定律,无法计算某些难以直接测量的反应焓变
D. 化学反应都伴随着能量变化和其他各种现象的出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面被氧化的铝分成两等分,若向其中一份中滴加1molL-1的NaOH溶液,向另一份中滴加x molL-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示.下列说法不正确的是( )

A. a=260
B. x=1mol/L
C. 该铝块的总质量为8.46g
D. 该铝块中氧化铝与铝单质的物质的量之比为3:20
查看答案和解析>>
科目:高中化学 来源: 题型:
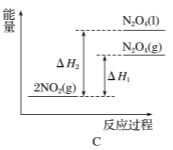
【题目】(1)已知:2NO2(g)![]() N2O4(g) ΔH1
N2O4(g) ΔH1
2NO2(g) ![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是 (填字母)。

(2)下图所示是某温度下,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式为
。反应中如果加入1 mol氮气和3 mol氢气,反应放出的能量 (填“大于”“等于”或“小于”)92 kJ,原因是 。

(3)室温下,1 g苯(C6H6)完全燃烧生成液态水和CO2,放出41.8 kJ的热量。写出C6H6燃烧的热化学方程式: 。
(4)已知:H2(g)+Cl2(g)===2HCl(g) ΔH=185 kJ·mol1,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com