乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产,回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C
2H
5OSO
3H),再水解生成乙醇,写出相应反应的化学方程式
;
(2)已知:
甲醇脱水反应 2CH
3OH(g)═CH
3OCH
3(g)+H
2O(g)△H
1=-23.9kJ?mol
-1甲醇制烯烃反应 2CH
3OH(g)═C
2H
4(g)+2H
2O(g)△H
2=-29.1kJ?mol
-1乙醇异构化反应 C
2H
5OH(g)═CH
3OCH
3(g)△H
3=+50.7kJ?mol
-1则乙烯气相直接水合反应C
2H
4(g)+H
2O(g)═C
2H
5OH(g)的△H=
kJ?mol
-1,与间接水合法相比,气相直接水合法的优点是
;
(3)如图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中
nH2O:
nC2H4=1:1)
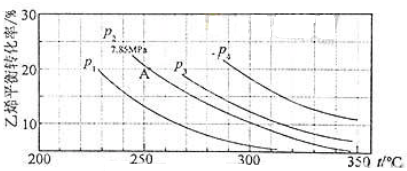
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K
p=
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);
②图中压强(P
1,P
2,P
3,P
4)大小顺序为
,理由是
;
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9MPa,
nH2O:
nC2H4=0.6:1,乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有
、
.

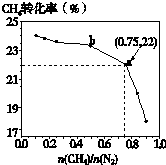 已知:3CH4(g)+2N2(g)
已知:3CH4(g)+2N2(g)


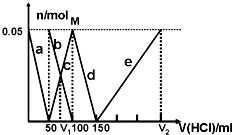 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+离子的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( ) 等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )
等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )