
金属晶体的形成是因为晶体中存在( )
A.金属阴离子间的相互作用
B.金属原子间的相互作用
C.金属阳离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用
科目:高中化学 来源: 题型:
某同学利用如图装置实现铜与浓硝酸、稀硝酸反应,过程如下:
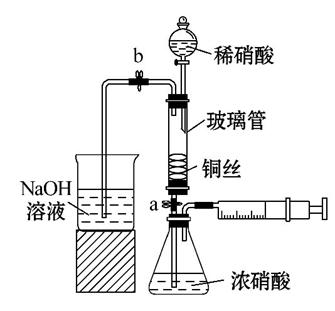
Ⅰ.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
Ⅲ.按如图所示装置连接仪器、检查气密性、装入化学试剂。
(1)过程Ⅰ发生反应的离子方程式是____________________________。
(2)写出过程Ⅲ中检查气密性的方法____________________________。
(3)过程Ⅲ的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是____________,一段时间后使反应停止的操作是__________,关闭a,取下注射器。
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生。稀硝酸充满玻璃管的实验目的是______________,该反应的离子方程式是__________________。
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如表所示(忽略温度对气体体积的影响):
| 实验编号 | 水温/℃ | 液面上升的高度 |
| 1 | 25 | 超过试管的2/3 |
| 2 | 50 | 不足试管的2/3 |
| 3 | 0 | 液面上升超过实验1 |
①根据上表得出的结论是温度越______(填“高”或“低”),进入试管中的溶液越多。
②查阅资料:
a.NO2与水反应的实际过程为2NO2+H2O====HNO3+HNO2,3HNO2====HNO3+2NO↑+H2O;
b.HNO2不稳定。
则产生上述现象的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列性质适合于离子晶体的是( )
A.熔点1 070℃,易溶于水,水溶液能导电
B.熔点10.31℃,液态不导电,水溶液能导电
C.能溶于CS2,熔点112.8℃,沸点444.6℃
D.熔点97.81℃,质软,导电,密度0.97 g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
碱金属卤化物是典型的离子晶体,它们的晶格能与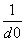 成正比(d0是晶体中最邻近的带有异性电荷离子的核间距)。下面说法错误的是( )
成正比(d0是晶体中最邻近的带有异性电荷离子的核间距)。下面说法错误的是( )
| 晶格能/kJ·mol-1 | 离子半径/pm | |
| ① | LiF LiCl LiBr LiI 1 031 845 807 752 | Li+ Na+ K+ 60 95 133 |
| ② | NaF NaCl NaBr NaI 915777 740 693 | F- Cl- Br- I- 136 181 195 216 |
| ③ | KF KCl KBr KI 812 708 676 641 |
A.晶格能的大小与离子半径成正比
B.阳离子相同、阴离子不同的离子晶体,阴离子半径越大,晶格能越小
C.阳离子不同、阴离子相同的离子晶体,阳离子半径越小,晶格能越大
D.金属卤化物晶体中,晶格能越小,还原性越强
查看答案和解析>>
科目:高中化学 来源: 题型:
参考表中物质的熔点,回答有关问题。
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点/℃ | -90.2 | -70.4 | 5.2 | 120.0 | -70.4 | -49.5 | -36.2 | -15.0 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的__________有关,随着__________的增大,熔点依次降低。
(2)硅的卤化物及硅、锗、锡、铅的氯化物的熔点与________________有关,随着________________增大,________________增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与__________有关,因为一般__________比__________的熔点高。
查看答案和解析>>
科目:高中化学 来源: 题型:
德国和美国科学家首次研制出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由多个正五边形构成的(如图所示)。请回答:
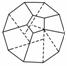
(1)C20分子中共有________个正五边形,共有 条棱边。C20晶体属于________(填晶体类型)。
(2)固体C60与C20相比较,熔点较高的应为________,理由是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com