
分析 1)反应中Mn元素化合价降低,化合价由+4价降低到+2价,Cl元素化合价升高,由-1价升高到0价,化合价升高值=化合价降低值=转移电子数;
(2)n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,参加反应的盐酸是被氧化盐酸的物质的量的2倍,结合反应的化学方程式计算.
解答 解(1)反应中Mn元素化合价降低,化合价由+4价降低到+2价,Cl元素化合价升高,由-1价升高到0价,氧化还原反应中得失电子数目相等,表现为化合价升降的总数相等,可表示为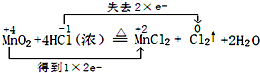 ,
,
答: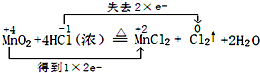 ;
;
(2)n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
87g 1mol
m 0.1mol
m=8.7g,
答:理论上需要8.7gMnO2参加反应;
②MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O 被氧化HCl
1mol 2mol
0.1mol n
n=0.2mol,
答:被氧化的HCl的物质的量为0.2mol.
点评 本题考查氧化还原反应,题目难度不大,注意根据元素化合价的变化以及反应的方程式进行计算即可.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 盐酸滴入澄清石灰水中:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 铜与硝酸银溶液反应:Cu+2Ag+═Cu2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 福尔马林可用于保存海鲜产品 | |
| B. | 硅胶吸附能力强,常用作催化剂载体和食品干燥剂 | |
| C. | 工业上利用Cl2与澄清石灰水反应制取漂白粉 | |
| D. | 天然纤维和合成纤维的主要成分是纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数 d>c>b>a | |
| B. | 单质的还原性D<C<B<A | |
| C. | 离子半径 C3->D->B+>A2+ | |
| D. | A、B、C最高价氧化物对应水化物溶液(等物质的量浓度)的pH值C>B>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com