
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:分析 (1)2p能级3个电子分别单独优先占据一个轨道;前4周期元素中,基态原子核外电子排布成单电子数最多,只能处于第四周期,根据洪特规则特例书写价层电子排布式;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;
(3)N2F2分子结构式为F-N=N-F;
(4)F元素电负性比H大,NF3中N周围电子密度减小,成键电子对之间的排斥力较小,因而键角较小;
(5)NH4BF4 中铵根离子中含有1个配位键,B原子与F之间形成1个配位键;
(6)①原子总数相同、价电子总数相同的分子或离子互为等电子体;
②由均摊法可知晶胞中白色球数目为4、黑色球数目为8,Na原子与氧原子数目之比为2:1,则白色球为氧原子、黑色球为Na原子,黑色球配位数为4,则白色球配位数为8,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:(1)2p能级3个电子分别单独优先占据一个轨道,符合洪特规则;前4周期元素中,基态原子核外电子排布成单电子数最多,只能处于第四周期,由洪特规则特例可知价层电子排布式为3d54s1,
故答案为:洪特规则;3d54s1;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,氮元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:N>O>C,
故答案为:N>O>C;
(3)N2F2分子结构式为F-N=N-F,分子中N原子含有1对孤对电子,N原子的杂化方式是sp2杂化,l mol N2F2含有3molσ键,
故答案为:sp2杂化;3;
(4)F元素电负性比H大,F元素电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度,成键电子对之间的排斥力较小,因而NF3的键角<NH3的键角,
故答案为:<;F元素电负性比H大,NF3中N周围电子密度小于NH3中N周围电子密度;
(5)NH4BF4 中铵根离子中含有1个配位键,B原子与F之间形成1个配位键,l mol NH4BF4 含有2mol配位键,
故答案为:2;
(6)①与N3-互为等电子体的分子或离子为CO2、CNO-等,
故答案为:CO2、CNO-;
②晶胞中白色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、黑色球数目为8,Na原子与氧原子数目之比为2:1,则白色球为氧原子、黑色球为Na原子,黑色球配位数为4,则白色球配位数为8,晶胞质量为4×$\frac{62}{6.02×1{0}^{23}}$g,则晶胞密度为4×$\frac{62}{6.02×1{0}^{23}}$g÷(566×10-10 cm)3=$\frac{4×62}{6.02×1{0}^{23}×(566×1{0}^{-10})^{3}}$g•cm-3,
故答案为:8;$\frac{4×62}{6.02×1{0}^{23}×(566×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式判断、配位键、价层电子对数互斥理论、等电子体、晶胞结构与计算等,(4)中键角判断为易错点、难点,注意同周期第一电离能异常情况.


科目:高中化学 来源: 题型:解答题


 (R、R′可以是氢原子、烃基或官能团)
(R、R′可以是氢原子、烃基或官能团) .
. .
. .
.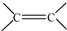 和
和 结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任两种).
结构的D的所有同分异构共有7种(不包括顺反异构体),写出其中任意两种的结构简式CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、HCOOCH2CH=CH2、HCOOCH=CHCH3、CH3COOCH=CH2、HCOOC(CH3)=CH2(其中任两种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的沸点:Y<W | |
| B. | 简单离子的半径:W>Y>Z>X | |
| C. | W的氧化物对应的水化物是一种强酸 | |
| D. | 与Z同族的下一周期元素的单质不能与N2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定时可用氯水代替过氧化氢氧化甲醛 | |
| B. | 足量H2O2氧化1molHCHO时放出的热量一定是①的2倍 | |
| C. | 上述方法测定甲醛含量时,如果H2O2过量,会导致甲醛含量的测定结果偏高 | |
| D. | H2O2氧化等物质的量甲醛(反应①)和甲酸时转移电子的数目相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,能稳定存在的R的氧化物都是酸性氧化物 | |
| B. | R的气态氢化物的水溶液具有强酸性 | |
| C. | R是金属元素 | |
| D. | R的气态氧化物不能在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  检验铁粉与水蒸气反应产生的氢气 | |
| B. |  快速制备和收集一定量的氨气 | |
| C. |  分离互溶但沸点相差较大的液体混合物 | |
| D. |  直接蒸发氯化铁溶液获得氯化铁晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 酸雨是指pH<7.0的雨水 | |
| C. | 居室中放置一盆石灰水可以吸收CO,预防中毒 | |
| D. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 2,2-二甲基戊醇 | B. | 2,2-二甲基-4-戊醇 | ||
| C. | 1,3,3-三甲基丁醇 | D. | 4,4-二甲基-2-戊醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com