


科目:高中化学 来源: 题型:
| A、在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 |
| B、使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 |
| C、清晨,在茂密的树林中,常常可以看到枝叶间透过的一道道光线 |
| D、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 常温下 |
| SO2 |
| A、MFe2Ox是还原剂 |
| B、SO2是该反应的催化剂 |
| C、X>Y |
| D、氧化性:MFe2Ox>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ),其过程如下:
),其过程如下: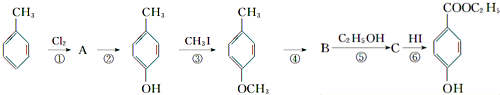
查看答案和解析>>
科目:高中化学 来源: 题型:
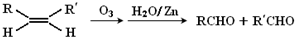

查看答案和解析>>
科目:高中化学 来源: 题型:
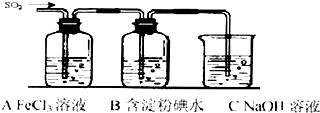
查看答案和解析>>
科目:高中化学 来源: 题型:
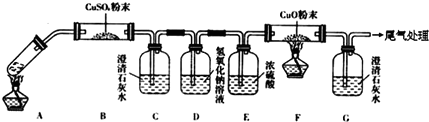
查看答案和解析>>
科目:高中化学 来源: 题型:
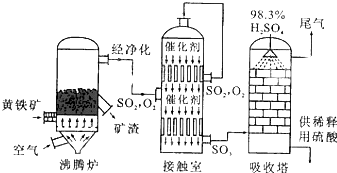 工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:
工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:查看答案和解析>>
科目:高中化学 来源: 题型:
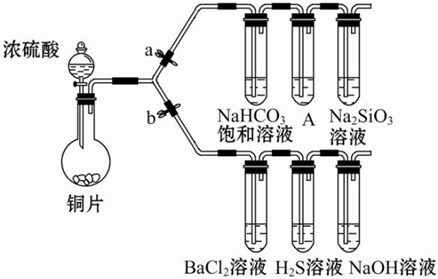
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com