
| A. | 3 mol H2S可还原4mol的KIO3 | |
| B. | 氧化剂和还原剂物质的量之比为5:4 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
分析 KI+5KIO3+3H2S=3I2+3K2SO4+3H2O中,KI中I元素的化合价由-1价升高为0,H2S中S元素的化合价由-2价升高为+6,KIO3中I元素的化合价由+5价降低为0,结合氧化还原反应中基本概念来解答.
解答 解:A.H2S中S元素的化合价由-2价升高为+6,KIO3中I元素的化合价由+5价降低为0,根据得失电子守恒,3molH2S可还原$\frac{3×8}{5}$mol的KIO3,故A错误;
B.该反应中KI中I元素的化合价由-1价升高为0为还原剂,H2S中S元素的化合价由-2价升高为+6为还原剂,KIO3中I元素的化合价由+5价降低为0为氧化剂,所以氧化剂和还原剂物质的量之比为5:4,故B正确;
C.因为I元素的化合价既升高又降低,则生成物I2既是氧化产物又是还原产物,故C错误;
D.该反应中KI中I元素的化合价由-1价升高为0,KIO3中I元素的化合价由+5价降低为0,根据得失电子守恒,1molKIO3可氧化5mol的KI,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及分析能力的考查,题目难度不大.


科目:高中化学 来源: 题型:实验题
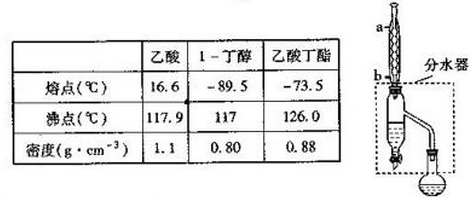

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
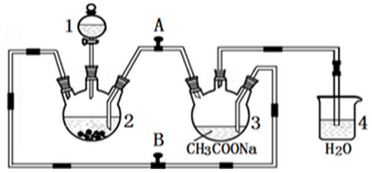
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
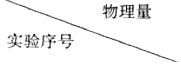 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 4 | 20 | 10 | |
| ② | 5 | 10 | 5 | |
| ③ | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
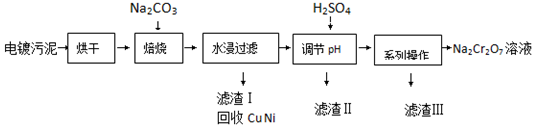
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4、9、24、14、28 | B. | 1、1、1、1、2 | C. | 8、9、12、10、20 | D. | 任意比均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液颜色保持不变,说明上述可逆反应达到平衡状态 | |
| B. | 若用绿矾(FeSO4•7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4 g | |
| C. | 常温下转化反应的平衡常数K=l04,则转化后所得溶液的pH=1 | |
| D. | 常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+ )降至1×10-5mol/L,应调溶液的pH=5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com