
| A. | 稀硫酸 | B. | 浓盐酸 | C. | 稀硝酸 | D. | 浓硫酸 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
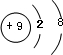 ,该元素与金属性最强的元素形成的化合物的电子式为
,该元素与金属性最强的元素形成的化合物的电子式为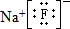 ;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).
;该化合物中存在的化学键为离子键 (选填“离子键”或“共价键”).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:
A、B、C、D、E五种元素均位于前四周期,原子序数逐渐增大,只有两种是金属元素.A、B、D三种元素在周期表中相对位置如图,其中A的价层电子排布为ns2np3,C的基态原子的第I电离能远小于第II电离能.E是第四期第IB族元素,回答下列问题:| A | B | |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| … | E | A | B | ||
| C | … | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若pH=7,HA的浓度一定为0.1 mol•L-1 | |
| B. | 若pH>7,HA的pH不可能等于1 | |
| C. | 若pH<7,溶液中的微粒浓度关系为:c(Na+)=c(HA)+c(A-) | |
| D. | 若pH=12,且HA为强酸时,HA的浓度应为0.08 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液,有白色沉淀产生 | |
| B. | 加入稀盐酸溶液,无明显现象,再加入BaCl2溶液,产生白色沉淀 | |
| C. | 加入Ba(NO3)2溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解 | |
| D. | 加入BaCl2溶液,产生白色沉淀,再加入稀盐酸,沉淀不溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com