
反应2H2S(g)  2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
A.加入催化剂,反应路径将发生改变,ΔH也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,体系温度降低
D.恒容体系,充入H2重新达到平衡后,H2浓度将减小
科目:高中化学 来源:2014-2015学年福建省高二上学期月考化学理试卷(解析版) 题型:选择题
下列情况下,反应速率相同的是
A.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应
B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
C.等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
等质量的CH4和NH3相比较,下列结论错误的是
A.它们的分子个数比为17:16
B.它们的原子个数比为17:16
C.它们的氢原子个数比为17:12
D.它们所含氢元素的质量比为17:12
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
下列实验操作中错误的是
A.在由氢氧化铜分解制氧化铜时,要边加热边用玻璃棒搅拌
B.用药匙或者纸槽把粉末状药品送入试管的底部
C.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
D.如果没有试管夹,可以临时手持试管给固体或液体加热
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是

A.X和Y不连接时,铜棒上会有金属银析出
B.X和Y用导线连接时,银棒是正极,发生氧化反应
C.若X接直流电源的正极,Y接负极,Ag+向铜电极移动
D.无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市五校高二上学期期中化学试卷(解析版) 题型:选择题
已知:H2(g)+F2(g)===2HF(g) 的能量变化如图所示,下列有关叙述中正确的是
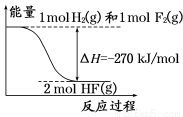
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.断裂1 mol H—H键和1 mol F—F 键放出的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)近年来雾霾天气在秋冬季节经常肆虐我国中东部地区。其中,汽车尾气和燃煤是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g)  2CO2 (g) +N2 (g)
2CO2 (g) +N2 (g)
在某密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
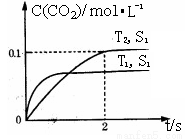
据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)  =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g)  N2O4(g)
N2O4(g)  =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过光电转化原理以廉价原料制备新产品的示意图。

写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a) 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为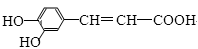 。下列有关咖啡酸的说法中,错误的是
。下列有关咖啡酸的说法中,错误的是
A.咖啡酸分子中的所有碳原子可能共平面
B.咖啡酸可以发生还原、酯化、加聚、显色等反应
C.1 mol咖啡酸可与4 mol Br2发生反应
D.1 mol咖啡酸与NaOH溶液反应最多消耗1 mol的NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省等四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(5分)从含镁、钾盐湖水中蒸发最后得到产物中含光卤石(xKCl·yMgCl2·zH2O),它是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:
①准确称取5.550g样品溶于水,配成100.0mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干
燥至恒重,得到白色固体0.580g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g。
通过计算确定样品的组成。
(1)原样品中含Mg2+的物质的量为____________,
(2)原样品中含Cl—的物质的量为____________,
(3)光卤石的化学式为____ __ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com