
分析 (1)酸、碱都是一元强电解质,pH=a的一元强酸溶液中氢离子浓度=10-a mol/L,pH=b的一元强碱中氢氧根离子浓度=10 b-14 mol/L,二者恰好反应时,说明酸和碱的物质的量相等,据此分析解答;
(2)AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,所以溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{\frac{Ksp(AgI)}{c(A{g}^{+})}}{\frac{Ksp(AgCl)}{c(A{g}^{+})}}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$;
(3)酸的电离常数越大,酸性越强,其盐的水解程度越小;水解程度越大,溶液中酸根离子浓度越小.
解答 解:(1)酸、碱都是一元强电解质,pH=a的一元强酸溶液中氢离子浓度=10-a mol/L,pH=b的一元强碱中氢氧根离子浓度=10 b-14 mol/L,二者恰好反应时,酸和碱的物质的量相等,即:10-a mol/L×VaL=10 b-14 mol/L×VbL,
$\frac{{V}_{a}}{Vb}$=$\frac{1{0}^{b-14}}{1{0}^{-a}}$=10 a+b-14,Va<Vb,所以10 a+b-14<1,所以a+b<14,
又a=0.5b,所以3a<14,所以a<$\frac{14}{3}$;b>7,a=0.5b>0.5×7=3.5,所以3.5<a<$\frac{14}{3}$,
故答案为:3.5<a<$\frac{14}{3}$;
(2)AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,所以溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{\frac{Ksp(AgI)}{c(A{g}^{+})}}{\frac{Ksp(AgCl)}{c(A{g}^{+})}}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$=$\frac{8.5×1{0}^{-17}}{1.8×1{0}^{-10}}$=4.7×10-7,
故答案为:4.7×10-7;
(3)向NaClO溶液中通入少量二氧化碳,生成HClO和HCO3-,离子方程式为ClO-+CO2+H2O═HClO+HCO3-;酸的电离常数越大,酸性越强,其盐的水解程度越小,HClO电离常数小于H2SO3,所以NaClO的水解程度大,浓度相同时NaClO溶液的pH大于Na2SO3 溶液的pH;水解程度越大,溶液中酸根离子浓度越小,水解程度:CO32->SO32->HCO3->HSO3-,则溶液中离子浓度:HSO3->HCO3->SO32->CO32-;
故答案为:大于;HSO3->HCO3->SO32->CO32-.
点评 本题考查了盐类水解、弱电解质的电离、溶度积的有关计算等知识点,根据弱电解质电离特点、盐类水解特点来分析解答即可,注意把握电离常数与酸性强弱的关系,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
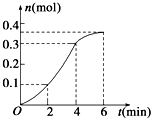
| A. | 反应开始2 min内平均反应速率最大 | |
| B. | 反应速率先增大后减小 | |
| C. | 反应2 min到第4 min内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2 min到第4 min内生成CO2的平均反应速率为前2 min的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于8.0 g | B. | 等于8.00 g | C. | 大于8.0 g | D. | 等于0.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n | B. | $\frac{n}{m}$ | C. | $\frac{12n}{m}$ | D. | n×NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铜溶液与锌粉反应:Cu2++Zn═Zn2++Cu | |
| B. | 稀 H2SO4与铁粉反应:2Fe2++6H+═Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与CuSO4 溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com