
| A. | 胆矾溶液 | B. | 浓食盐 | C. | 浓硝酸 | D. | 浓AlCl3溶液 |
分析 A、铁与硫酸铜溶液发生置换反应;
B、浓食盐与铁制容器构成原电池,发生电化学腐蚀;
C、铁在浓硝酸中发生钝化现象;
D、氯化铝溶液是强酸弱碱盐溶液水解呈酸性,能腐蚀铁.
解答 解:A、铁与硫酸铜溶液发生置换反应,所以铁制容器不能盛放胆矾溶液,故A错误;
B、浓食盐与铁制容器构成原电池,发生吸氧腐蚀,所以铁因发生电化学腐蚀而溶解,故B错误;
C、铁在浓硝酸中发生钝化现象,表面形成致密的氧化膜,保护了铁,所以能用铁制容器盛放浓硝酸,故C正确;
D、氯化铝溶液是强酸弱碱盐溶液水解呈酸性,能腐蚀铁,故D错误;
故选D.
点评 本题考查学生金属铁的性质,注意常温下浓硫酸、浓硝酸遇到金属铁会发生钝化这一知识点,难度不大.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol•L-1 | 1 | 2 | 1 |
| c(A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 实验Ⅲ的化学平衡常数K<1 | |
| B. | 实验放出的热量关系为b=2a | |
| C. | 实验Ⅲ在30 min达到平衡,30 min内A的速率:v(A)=0.002 5 mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、NO3- | B. | Ag+、K+、NO3-、Na+ | ||
| C. | H+、Mg2+、SO42-、NO3- | D. | Na+、SO42-、Cl-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
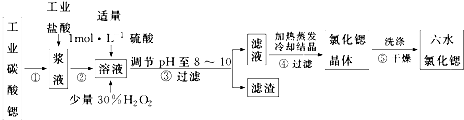
| SrSO4 | BaSO4 | Sr(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| Ksp | 3.3×10-7 | 1.1×10-10 | 3.2×10-4 | 2.6×10-39 | 4.87×10-17 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
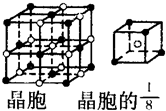 A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水.
A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水. ”表示)位于该正方体的顶点或面心;阴离子(用“
”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心.该化合物的电子式是
”表示)均位于小正方体中心.该化合物的电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
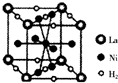 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. ④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.
④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com