
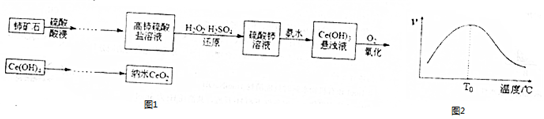
分析 (1)一定容积规格的容量瓶只能配制相应体积的溶液,由于没有950ml的容量瓶,选择大于950ml相近规格的容量瓶;根据化学式可知硫酸铜的物质的量等于硫酸铜晶体的物质的量,根据m=cnM计算所需胆矾的质量;
(2)亚硫酸根和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀;
(3)乙醇和水易挥发,CuCl具有还原性,可以被空气氧化;
(4)反应Cu+HCl+O2=CuCl+HO2中Cu元素化合价升高,被氧化,O元素化合价降低,被还原,O2为氧化剂,结合元素化合价的变化解答该题.
解答 解:(1)由于没有950ml的容量瓶,选择大于950ml相近规格的容量瓶,所以应选择1000ml规格容量瓶,
根据化学式可知硫酸铜的物质的量等于硫酸铜晶体的物质的量,所以需要胆矾的质量为:
1L×2mol/L×250g/mol=500g,
故答案为:500;
(2)Na2SO3和硫酸铜之间可以发生氧化还原反应生成氯化亚铜沉淀,反应的离子方程式为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+,
故答案为:2Cu2++SO32-+2Cl-+H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+SO42-+2H+;
(3)CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,这样可以加快乙醇和水的蒸发,防止CuCl被空气氧化,
故答案为:防止CuCl被空气氧化(或加快乙醇和水的蒸发);
(4)A.O元素化合价降低,被还原,HO2为还原产物,故A错误;
B.HO2为超氧酸,应具有酸性,可与碱反应,故B错误;
C.HO2(超氧酸) 是一种弱酸,所以HO2 的电离方程式为HO2?H++O2-,故C正确;
D.反应中Cu元素化合价由0价升高到+1价,则1molCu参加反应有1mol电子发生转移,故D错误.
故选C.
点评 本题考查了配制一定物质的浓度溶液的配制、铜及其化合物的性质,注意知识的迁移和应用,掌握氧化还原知识以及铜的化合物的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>W>Z | B. | 原子序数:Y>X>Z>W | ||
| C. | 原子最外层电子数:Y>X>Z>W | D. | 原子的电子层数:X=Y>W=Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于0.1mol/L | B. | 大于0.1mol/L | C. | 小于0.1mol/L | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaX |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
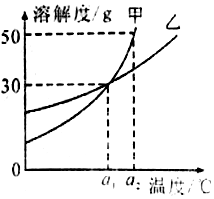
| A. | a1℃时甲和乙的饱和溶液,升温到a2℃时仍是饱和溶液 | |
| B. | 甲和乙的溶解度相等 | |
| C. | a1℃时,甲和乙各30g分别加入100g的水中,均形成饱和溶液 | |
| D. | a2℃时,在100g水中加入60g甲,形成不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
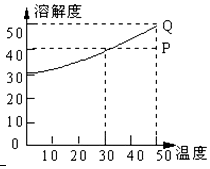 有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )
有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )| A. | 50℃时,若该盐溶液含A克溶质,保持温度不变,加入A/4 g溶质,溶液必变成饱和溶液 | |
| B. | 50℃时,140g P点溶液最少需蒸发掉20g水才能形成饱和溶液 | |
| C. | 该溶液冷却至0℃时,析出溶质10 g | |
| D. | 在保持溶质及溶剂质量不变的情况下,使P点溶液达到饱和需降温20℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com