
【题目】下列各选项中两物质熔、沸点比较不正确的是
A. Na>K B. CCl4>SiF4 C. H2O>H2S D. Br2>I2
科目:高中化学 来源: 题型:
【题目】(1) 3.01×1023个CO2分子中含_____________mol氧原子,在标准状况下其体积为____L,0.4 molOH-的中有 ______个电子。
(2)实验中需取0.1mol CuSO4配制溶液,若用CuSO4 5H2O替代,则应称取CuSO4 5H2O的质最为___g。
(3)同温同压下,等质量的N2和CO2所含分子数比为_____,体积比为________。
(4)某气体在标准状况下的密度为1.25g/L,则28g该气体所含有的分子数为_____________。
(5)在标准状况下22.4L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为____g。
(6)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L的稀硫酸l00mL,配制过程中需量取浓硫酸____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:

(1)在A试管内发生反应的化学方程式是________________________________。
(2)B装置的作用是______________________________。
(3)在双球干燥管内发生反应的化学方程式为_____________________________。
(4)双球干燥管内观察到的实验现象是______________________。
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:

已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为___________。
(2)根据实验目的,选择合适的实验步骤:①→____________。
①组装好装置,_________________(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加人冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:_________________。
(4)反应完毕后,U形管内的现象是_________;分离溴乙烷时所需的玻璃仪器是___________。
(5)假设最初取用的无水乙醇是71.9 mL,最后得到的纯净的溴乙烷是66.2 mL,则溴乙烷的产率为______________(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A 合成黄樟油(E)和香料F的路线如下(部分反应条件已略去):
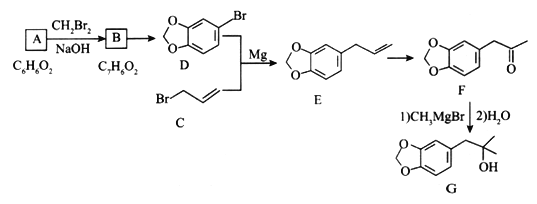
请回答下列问题:
(l)下列有关说法正确的是______(填选项字母)。
a.化合物A 核磁共振氢谱为两组峰
b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子
d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________。
(3)D含有的官能团名称为_______,C的同分异构体中具有顺反异构的是______(填名称,不必注明“顺”“反”)。
(4)写出A→B的化学反应方程式:_________。
(5)满足下列条件的E的同分异构体W有______种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为________。
① lmolW与足量NaOH溶液反应,能消耗2molNaOH
② 能发生银镜反应
③ 苯环上只有两个取代苯,能发生聚合反应
(6)参照上述合成路线,写出以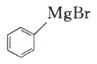 、
、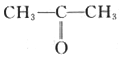 为主要原料(无机试剂任选),设计制备
为主要原料(无机试剂任选),设计制备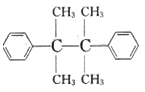 的合成路线:________________________。
的合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是

A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( )
①加盐酸溶解 ②加足量烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A. ①⑥⑤③ B. ②③④③ C. ②③⑤③ D. ①③⑤③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用甲苯生产对羟基苯甲酸乙酯:![]() ,下列反应①~⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明)。
,下列反应①~⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明)。

回答下列问题:
(1)有机物A的结构简式为___________________。
(2)反应②的化学方程式是:__________________________。
(3)试剂x是_______________,反应⑥的反应类型是_____________反应。
(4)反应⑤的化学方程式是:_______________________________。
(5)合成路线中设计③、⑤两步反应的目的是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com