
| A. | 甲烷 | B. | 氟氯代烃 | C. | 二氧化碳 | D. | 二氧化硫 |
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 化学性质 |
| H2C2O4 | 189.5℃ | 二元弱酸,有毒,具有腐蚀性,易溶于水,100℃开始升华,157℃时开始分解,与浓硫酸混合加热会产生CO2、CO和H2O,草酸钙和草酸氢钙均为白色不溶物 |
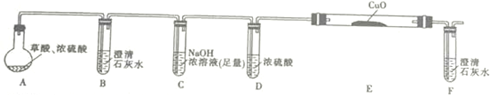
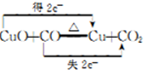 .
.| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| Ⅰ | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅱ | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| Ⅲ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
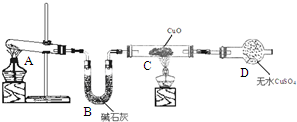 某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题:
某化学学习小组同学根据实验室现有的制取氨气的药品,设计了如图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
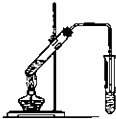 (1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.
(1)某同学欲用12mol/L的浓盐酸配制1mol/L的盐酸250mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2与水反应生成硫酸 | |
| B. | 我国大气中SO2的主要来源是汽车排出的尾气 | |
| C. | SO2能漂白某些物质如品红溶液,说明它具有氧化性 | |
| D. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 限塑的主要意义是减少白色污染 | |
| B. | 塑料袋的材料主要是聚乙烯、聚氯乙烯等 | |
| C. | 聚乙烯、聚氯乙烯等塑料都是天然高分子材料 | |
| D. | 聚乙烯是由乙烯分子通过加成反应聚合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
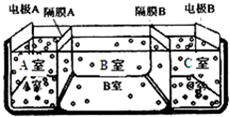 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑩ | |||||
| 3 | ① | ③ | ④ | ⑦ | ⑧ | ⑨ | ||
| 4 | ② |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com