
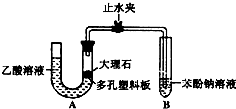
 某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱,该校学生先组装了如图的实验装置(夹持仪器已略去).进行了下述一些实验:
某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱,该校学生先组装了如图的实验装置(夹持仪器已略去).进行了下述一些实验:

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源:2007年1月江苏省如皋中学高三化学期末综合练习-新人教 题型:058
| |||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
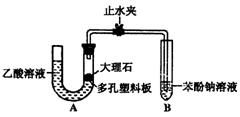 某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱,该校学生先组装了右图的实验装置(夹持仪器已略去)。进行了
某校化学兴趣小组学生为了探究乙酸、碳酸和苯酚的酸性强弱,该校学生先组装了右图的实验装置(夹持仪器已略去)。进行了
下述一些实验:
(1)某生检查装置A的气密性时,先关闭止水
夹,从左管向U型管内加水,至左管液面高于右
管液面,静置一段时间后,若U型管两侧液面差不发生变化,则气密性良好。你认为该学生的操作正确与否? (填“正确”或“错误”)
(2)大理石与乙酸溶液反应的化学方程式为
(3)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 ,反应的离子方程式为 。
(4)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,他的理由是 。改进该装置的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验试剂 | 操作 | 现象 | 结论 | 有关方程式 |
| ______ | ______ | ______ | ______ | ______ |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年浙江省杭州市七校联考高二(上)期中化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com