
【题目】NF3是微电子工业中常用的一种等离子蚀刻气体,具有较强的氧化性,工业生产NF3常用的方法有气一液反应法、气一固反应法和电解法等。
(1)气一液反应法中发生的主反应和副反应包括:
3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1
3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
4F2(g)+2NH3(l)=N2F2(g)+6HF(l) △H3
NH3(l)+2HF(l)=NH4HF2(l) △H4
△H1=_____。部分键能数据如下表所示,△H3=_____kJ/mol。
化学键 | N-N | N=N | N | H-F | F-F | N-H | N-F |
键能(kJ/mol) | 159 | 456 | 946 | 565 | 153 | 389 | 272 |
(2)气一固反应法主要包括两步反应:
(NH4)3AlF6(s)+6F2(g)![]() 2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
2NF3(g)+8HF(g)+NH4AlF4(s) 反应Ⅰ
NH4AlF4(s)+3F2(g)![]() NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
NF3(g)+4HF(g)+ AlF3(s) 反应Ⅱ
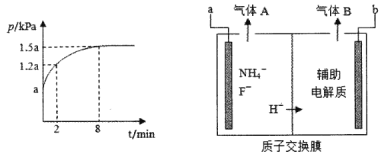
反应I的平衡常数K1和反应II的平衡常数的关系是___。若在恒温、恒容的密闭容器中模拟气一固反应法(固体足量),起始时F2的浓度为5mol/L,反应过程中容器中压强一随时间变化曲线如图所示,则前2min的平均反应速率v(NF3)=___mol/(Lmin),该温度下K2=___。
(3)电解法是通过电解含氟的熔融盐生产NF3,其原理如图所示。a需要接电源的____(填“正极”或“负极”),生成气体A的电极反应是____。
(4)用NF3对多晶硅电子元件进行蚀刻时不会在电子元件表面形成任何残留物,其原因是_____。(用化学用语解释)
【答案】△H2+△H4 -1444 K1=K22 0.25 400mol2/L2 正极 NH4+-6e-+3F-=NF3+4H+或NH4+-6e-+7F-=NF3+4HF 4NF3+3Si=2N2↑+3SiF4↑
【解析】
(1)已知:②3F2(g)+NH4HF2(l)=NF3(g)+5HF(l) △H2
④NH3(l)+2HF(l)=NH4HF2(l) △H4
根据盖斯定律,由②+④得反应3F2(g)+NH3(l)=NF3(g)+3HF(l) △H1=△H2+△H4;
N2F2的结构式是F-N=N-F,反应热=反应物总键能-生成物总键能,因此△H3=4×153+6×389-6×565-2×272-456=-1444kJ/mol;
(2) 根据反应(NH4)3AlF6(s)+6F2(g)![]() 2NF3(g)+8HF(g)+NH4AlF4(s)可得K1=
2NF3(g)+8HF(g)+NH4AlF4(s)可得K1=![]() ;
;
根据反应NH4AlF4(s)+3F2(g)![]() NF3(g)+4HF(g)+ AlF3(s)可得K2=
NF3(g)+4HF(g)+ AlF3(s)可得K2=![]() ;
;
故K1=K22;
恒温、恒容的密闭容器中压强之比等于气体的总物质的量浓度之比,因此2min时容器中气体总浓度为6mol/L,平衡时气体总浓度为7.5mol/L。两个反应中三种气体的化学计量数之比相同,计算浓度时可根据一个计算;
NH4AlF4(s)+3F2(g)![]() NF3(g)+4HF(g)+ AlF3(s) △c
NF3(g)+4HF(g)+ AlF3(s) △c
3 1 4 2
2min内浓度变化 0.5mol/L (6-5)mol/L
因此v(NF3)=0.25mol/(Lmin);
用同样的方法可算出平衡时F2(g)、NF3(g)、HF(g)的浓度依次是1.25mol/L、1.25mol/L、5mol/L,因此K2=![]() =400mol2/L2;
=400mol2/L2;
(3)根据图中信息可知,氢离子向b电极移动,则b为阴极。a为阳极,需要接电源的正极,阳极NH4+失电子产生NF3,生成气体A的电极反应是NH4+-6e-+3F-=NF3+4H+或NH4+-6e-+7F-=NF3+4HF;
(4)用NF3对多晶硅电子元件进行蚀刻时不会在电子元件表面形成任何残留物,因发生反应4NF3+3Si=2N2↑+3SiF4↑。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】已知:苯酚与Fe3+在溶液中存在可逆反应:Fe3+ + 6C6H5OH![]() H3Fe(OC6H5) 6 + 3H+,其中H3Fe(OC6H5) 6显紫色。实验如下:
H3Fe(OC6H5) 6 + 3H+,其中H3Fe(OC6H5) 6显紫色。实验如下:
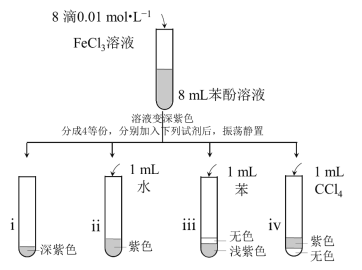
下列说法不正确的是:
A. i是空白对照实验
B. 向ii中滴加几滴浓盐酸,溶液颜色变浅
C. iii、iv中无色层中的溶剂分别为苯和CCl4
D. 苯酚在苯中的溶解性小于在CCl4中的溶解性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发)。下列说法不正确的是

A. M点溶液中水的电离程度比原溶液小
B. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
C. 随着NaOH的加入,  不断增大
不断增大
D. 当n(Na0H)=0.1mol时,c(Na+)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是( )
A.MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
B.Na2CO3+CO2+H2O=2NaHCO3
C.SiO2+2C![]() Si+2CO↑
Si+2CO↑
D.NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为____,其原子核外有_____种不同运动状态的电子,基态Mn3+含有的未成对电子数是_____。
(2)CH3COOH中碳原子的杂化形式为___。CH3COOH能与H2O以任意比互溶的原因是____。
(3)NO3-的空间构型是__,与NO3-互为等电子体的分子的化学式是____(任写一种)。
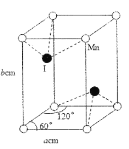
(4)碘与锰形成的某种化合物晶胞结构及参数如图所示,该化合物的化学式是___,晶胞密度p为___gcm3。伏伽德罗常数的数值用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,固体A是铁锈的主要成分。
![]()
请回答:
(1)固体C的化学式是___,上述框图中体现了SO2的___(填“氧化性”、“还原性”或“漂白性”)。
(2)写出A→B的化学方程式___。
(3)写出D→E的离子方程式___。
(4)若通入的SO2是足量的,请你设计实验方案检验“溶液D”中的金属阳离子___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)为过渡元素,可形成多价态化合物,全钒液流电池是一种新型的绿色环保储能系统,工作原理如下图:

已知:
离子种类 | VO2+ | VO2+ | V3+ | V2+ |
颜色 | 黄色 | 蓝色 | 绿色 | 紫色 |
(1)全钒液流电池放电时V2+发生氧化反应,该电池放电时总反应式是_______
(2)当完成储能时,正极溶液的颜色是 __________
(3)质子交换膜的作用是_________
(4)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液酸碱性不同钒元素的存在形式不同:
钒的化合价 | 酸性 | 碱性 |
+4价 | VO2+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①滤液中钒元素的主要存在形式为_______
②滤渣在空气中由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀的反应过程_______________、____________。
③萃取、反萃取可实现钒的分离和富集,过程可简单表示为(HA为有机萃取剂):
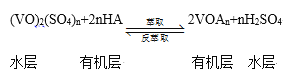
萃取时必须加入适量碱,其原因是 __________
④纯钒可由熔盐电解法精炼,粗钒(含杂质)作____极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在c(OH-)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3-
D. Kw/c(H+)=10-10 mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com