
已知难溶电解质在水溶液中存在溶解平衡:
MmAn(s) mMn+(aq)+nAm-(aq)
mMn+(aq)+nAm-(aq)
Ksp=c(Mn+)m·c(Am-)n,称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
|
难溶电解质 |
CaCO3 |
CaSO4 |
MgCO3 |
Mg(OH)2 |
|
Ksp |
2.8×10-9 |
9.1×10-6 |
6.8×10-6 |
1.8×10-11 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol ·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO3 3 g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④______________________________________________________________________。
(1)由题中信息Ksp越大,表示电解质的溶解度越________(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:_____________________________。
(3)设计第③步的目的是________________________________________。
(4)请补充第④步操作及发生的现象:_________________________________。
(1)大
(2)Na2CO3+CaSO4===Na2SO4+CaCO3
(3)洗去沉淀中附着的SO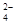
(4)向沉淀中加入足量的盐酸,沉淀完全溶解
【解析】由Ksp表达式不难看出其与溶解度的关系,在硫酸钙的悬浊液中存在着:CaSO4(s)
 SO
SO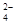 (aq)+Ca2+(aq),而加入Na2CO3后,溶液中CO
(aq)+Ca2+(aq),而加入Na2CO3后,溶液中CO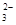 浓度较大,而CaCO3的Ksp较小,故CO
浓度较大,而CaCO3的Ksp较小,故CO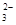 与Ca2+结合生成沉淀,即CO
与Ca2+结合生成沉淀,即CO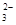 +Ca2+===CaCO3。既然是探究性实验,必须验证所推测结果的正确性,故设计了③④步操作,即验证所得固体是否为碳酸钙。
+Ca2+===CaCO3。既然是探究性实验,必须验证所推测结果的正确性,故设计了③④步操作,即验证所得固体是否为碳酸钙。
考点:难溶电解质溶解平衡的应用及实验探究提高
点评:本题为一道融难溶电解质的溶解平衡原理的实验题,综合能力比较强。要注意实验步骤和实验现象的书写和描述。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011届黑龙江省牡丹江一中高三上学期期末考试化学试卷 题型:填空题
(15分)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ.有甲、乙两个容积相等的恒容密闭容器,
发生反应3A(g)+B(g) 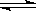 xC(g) △H = QKJ/mol
xC(g) △H = QKJ/mol
回答下列问题:
(1)下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号)
①化学反应速率:v(A)="3v(B) " ②混合气体的密度保持不变
③有3molA消耗的同时有1molB生成 ④ C的浓度保持不变
(2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q 0(填“大于”或“小于”)
(3)向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应3A(g)+B(g) 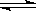 xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2 。
xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2 。
①若平衡时,甲、乙两容器中A的物质的量相等,则x= ;
②平衡时甲中A的体积分数为 ;
③若平衡时两容器的压强不相等,则两容器中压强之比为
Ⅱ.(1)pH=3的盐酸a L,分别与下列3种溶液混合,充分反应后溶液呈中性:
①pH=11的氨水b L;②物质的量浓度为1×10-3 mol/L 氨水c L;
③c(OH-)=1×10-3 mol/L的Ba(OH)2溶液d L;
试判断a、b、c、d的大小关系正确的是
A.a=b>c>d B.b>a=d>c C.c>a>d>b D.c>a=d>b
(2)已知室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,两溶液中c(H+) ? c(OH-)=___________;各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________溶液;各取5mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(3)同浓度的下列溶液:①NH4Al(SO4)2;②NH4Cl;③NH3·H2O;④CH3COONH4,其中c(NH4+) 由大到小的顺序是: (填编号)。
Ⅲ.一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数Ksp=cm(An+)×cn(Bm—),称为难溶电解质的溶度积。
(1)在25℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是 ;
(2)下列叙述不正确的是 (填字母)
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同。
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市六校高三第三次联考理综化学试卷(解析版) 题型:选择题
一定温度下的难溶电解质在水溶液中达到溶解平衡时。已知下表数据
|
物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
|
完全沉淀时的PH值 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是
A.向该溶液中加少量铁粉不能观察到红色固体析出
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
D.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com