
| A. | 平衡向正反应方向移动 | B. | m+n<p | ||
| C. | 气体A的转化率升高 | D. | C气体的体积分数增大 |
分析 将混合气体的体积压缩到原来的$\frac{1}{2}$,则压强变为原来的2倍,若平衡不移动,C的浓度为原平衡时C的浓度的2倍,实际上C的浓度是用来的1.9倍,说明平衡向逆反应方向移动,则m+n<p.
解答 解:将混合气体的体积压缩到原来的$\frac{1}{2}$,则压强变为原来的2倍,若平衡不移动,C的浓度为原平衡时C的浓度的2倍,实际上C的浓度是用来的1.9倍,说明平衡向逆反应方向移动,
A.通过以上分析知,平衡向逆反应方向移动,故A错误;
B.增大压强平衡向逆反应方向移动,则逆方向是气体体积缩小的方向移动,则m+n<p,故B正确;
C.平衡向逆反应方向移动,则A的转化率降低,故C错误;
D.平衡向逆反应方向移动,则C气体的体积分数减小,故D错误;
故选:B.
点评 本题考查了压强对化学平衡的影响,解题时往往容易漏掉减小体积的一瞬间各物质的浓度变为原来的2倍,从而导致出错.


科目:高中化学 来源: 题型:选择题
| A. | 实验室制氢气,为了加快反应速率,可将稀硫酸改成浓硫酸 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,氢气转化率增大 | |
| D. | 反应4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s)的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯硅可用于制作光导纤维 | B. | 光化学烟雾的形成与氮氧化物有关 | ||
| C. | 氧化铝可用于制作高温耐火材料 | D. | 明矾可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的裂化、煤的液化、蛋白质的盐析、焰色反应都是化学变化 | |
| B. | 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料 | |
| C. | 铅蓄电池是常见的二次电池.性能优良.比能量高.缺点是废弃电池污染严重 | |
| D. | 在新型催化剂条件下通过电力可将二氧化碳氧化为甲醇、甲烷等燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
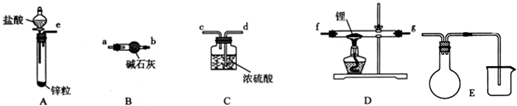
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后再用NaOH润洗,再加人一定体积待测NaOH溶液 | |
| C. | 滴定时,没有逐出滴定管尖嘴的气泡,滴定后气泡消失 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
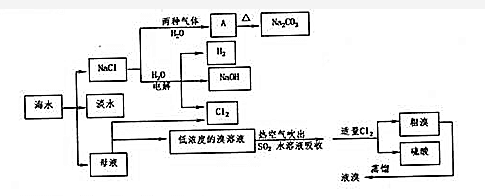
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y可以形成5种以上的化合物 | |
| B. | M的氧化物对应的水化物的酸性一定比W的强 | |
| C. | W的气态氢化物与M的单质能发生置换反应 | |
| D. | Z、M的单质在一定探究下均能和强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
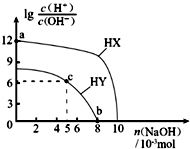 25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )
25℃,在100mL 0.1mol?L-1的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg$\frac{c({H}^{+})}{c(O{H}^{-})}$随加入NaOH的物质的量的变化如图所示.下列叙述不正确的是( )| A. | 酸性:HX>HY | |
| B. | a点由水电离出的c(H+)=10-12 mol?L-1 | |
| C. | c点溶液中:c(Y-)>c(HY) | |
| D. | b点时,溶液pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com