
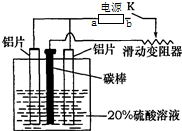
 ����������������һ�ֳ��õĽ������洦������������ʹ���ı�������һ�����ܵ�����Ĥ��ij��ѧ�о�С����ʵ�����а����в���ģ����������̣�װ����ͼ����д���пհף�
����������������һ�ֳ��õĽ������洦������������ʹ���ı�������һ�����ܵ�����Ĥ��ij��ѧ�о�С����ʵ�����а����в���ģ����������̣�װ����ͼ����д���пհף����� ��1�������������������У���������������̼����������
��2��������������������������������������������������Һ�У�
��3������װ��ͼ�������ӵ�Դ�����ڵ����� ������ʧ������������������Һ���������������õ���������������
��4����������Ҫ��ϡ������Һ�����ԺͰ�ˮ֮�䷢���кͷ�Ӧ��
��� �⣺��1�������������������У���������������̼��������������a���������ʴ�Ϊ��������
��2��������������������������������������������������Һ�з�Ӧ�������ǻ��������ƻ�ƫ�����ƣ���Ӧ�����ӷ���ʽΪ��Al2O3+2OH-+3H2O=2[A1��OH��4]-��Al2O3+2OH-=2AlO2-+H2O�������������Ƶ������ǣ���ȥ����������ۺ�����Ĥ���ʴ�Ϊ����ȥ����������ۺ�����Ĥ��
��3��װ��ͼ�������ӵ�Դ�����ڵ����� ������ʧ�����������������缫��ӦΪ��2Al+3H2O��Al2O3+6H++6e-����Һ���������������õ����������������缫��ӦΪ��2H++2e-=H2�����ʴ�Ϊ��2Al-6e-+3H2O=Al2O3+6H+��2H++2e-=H2����
��4����1%ϡ��ˮ�кͱ������Һ���Ǻ�ϡ���ᷢ���ķ�Ӧ����Ӧ���ӷ���ʽΪ��NH3•H2O+H+=NH4++H2O��
�ʴ�Ϊ��NH3•H2O+H+=NH4++H2O��
���� ���⿼�������仯�������ʵ�Ӧ�ã�ԭ��ء�����ԭ�������жϣ��缫��Ӧ��д���������������Ϣ�ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����NA��������̼���� | B�� | ����1molO2 | ||
| C�� | ����Ϊ44 g•mol-1 | D�� | ��ռ�����Ϊ22.4L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
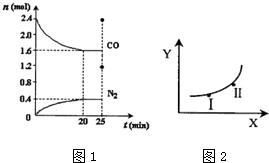
| ����X | ����Y | |
| a | ѹǿ | ��Ӧ��ƽ�ⳣ�� |
| b | �¶� | CO��ƽ��Ũ�� |
| c | �¶� | N2��������� |
| d | ���� | NO��ƽ��ת���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �Ҵ� | ������ | 1-���� | 1-�嶡�� | |
| �ܶ�/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| �е�/�� | 78.5 | 38.4 | 117.2 | 101.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.5 mol 1��3-����ϩ�����к���C=C˫����Ϊ NA | |
| B�� | 1 mol�ǻ���-OH�������ĵ�������Ϊ9NA | |
| C�� | 14g��ϩ����ϩ�Ļ������������ԭ������Ϊ3NA | |
| D�� | ��״���£�1L������ȫȼ�������ɵ���̬����ķ�����Ϊ7/22.4NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl2������ԭ��Ӧ | |
| B�� | �������뻹ԭ�������ʵ���֮��Ϊ1��2 | |
| C�� | ����Ӧ������3molH2O����ת�Ƶ���2mol | |
| D�� | ���������ø÷�Ӧ���Խ���ѧ��ת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �����ǹ�ҵ��������Ϊ��Ҫ�IJ�Ʒ֮һ���ڻ�ѧ��ҵ�ĺܶ�����Ҫ�õ�Ũ���ᣮ
�����ǹ�ҵ��������Ϊ��Ҫ�IJ�Ʒ֮һ���ڻ�ѧ��ҵ�ĺܶ�����Ҫ�õ�Ũ���ᣮ| ѹǿ/MPa SO2ת���� �¶�/�� | 1������ѹ | 5������ѹ | 10������ѹ | 15������ѹ |
| 400�� | 0.9961 | 0.9972 | 0.9984 | 0.9989 |
| 500�� | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600�� | 0.8528 | 0.8897 | 0.9276 | 0.9468 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com