
【题目】现要测定某氯化铁与氯化亚铁混合物中铁元素的质量分数。实验按以下步骤进行:
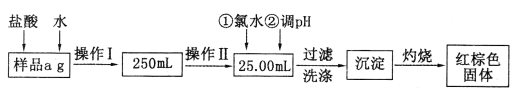
I.根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有_______、_______(填仪器名称)。
(2)加入氯水发生反应的离子方程式为______________________________。
(3)将沉淀物灼烧后,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温,称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是___________________;若坩埚质量是w1g,坩埚与灼烧后固体总质量是w2g,则样品中铁元素的质量分数是_______________。
II.有同学提出,还可以采用以下方法来测定:
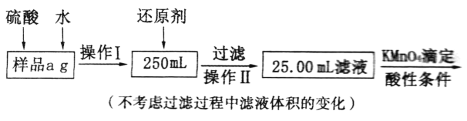
(4)溶解样品改用了硫酸,而不再用盐酸,为什么?_____________________________。
(5)选择的还原剂是否能用铁_____(填“是”或“否”),原因是______________________。
(6))若滴定消耗c mol· L-1KMnO4溶液b mL,则样品中铁元素的质量分数是__________。
【答案】250mL容量瓶 胶头滴管 2Fe2++Cl2=2Fe3++2Cl- 再次加热冷却并称量,直至两次质量差小于0.1g ![]() ×100% 过量的盐酸能被酸性高锰酸钾溶液氧化,对KMnO4的滴定过程有干扰 否 如果用铁做还原剂,会与Fe3+、过量的硫酸反应生成Fe2+,干扰原混合物中铁元素的测定 2.8bc/a
×100% 过量的盐酸能被酸性高锰酸钾溶液氧化,对KMnO4的滴定过程有干扰 否 如果用铁做还原剂,会与Fe3+、过量的硫酸反应生成Fe2+,干扰原混合物中铁元素的测定 2.8bc/a
【解析】
本题按照两种不同的实验设计进行了某氯化铁与氯化亚铁混合物中铁元素的质量分数,方案I为沉淀法,方案II滴定法,两种方案中均是先准确配制一定体积的溶液,然后取样进行测定,计算的依据为铁元素的质量守恒,据此分析解答。
Ⅰ.(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有250mL容量瓶、胶头滴管;故答案为:250mL容量瓶、胶头滴管;
(2)加入氯水将溶液中的Fe2+氧化转变成Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(3)为了减少误差,需再次加热冷却并称量,直至两次质量差小于0.1g,因b1-b2=0.3g>0.1g,所以接下来需再次加热冷却并称量,直至两次质量差小于0.1g;由铁元素质量守恒可得红棕色固体中铁元素就是样品中的铁,Fe2O3中铁元素的质量为(W2-W1)g×![]() ;则样品中铁元素的质量为:(W2-W1)g×
;则样品中铁元素的质量为:(W2-W1)g×![]() ×
×![]() =
=![]() g=7(W2-W1)g,所以样品中铁元素的质量分数为:
g=7(W2-W1)g,所以样品中铁元素的质量分数为:![]() ×100%,故答案为:再次加热冷却并称量,直至两次质量差小于0.1g;
×100%,故答案为:再次加热冷却并称量,直至两次质量差小于0.1g;![]() ×100%;
×100%;
II.(4)溶解样品改用了硫酸,而不再用盐酸,是因为过量的盐酸会被酸性KMnO4溶液氧化,对KMnO4的滴定有干扰,故答案为:过量的盐酸能被酸性高锰酸钾溶液氧化,对KMnO4的滴定过程有干扰;
(5)选择的还原剂不能用铁,因为如果用铁做还原剂,会与Fe3+、过量的硫酸反应生成Fe2+,从而干扰原混合物中铁元素的测定;故答案为:否;如果用铁做还原剂,会与Fe3+、过量的硫酸反应生成Fe2+,干扰原混合物中铁元素的测定;
(6)Fe与KMnO4反应的离子方程式是:5Fe2++ MnO4-+8H+= 5Fe3++Mn2++4H2O。n(MnO4-)=bc×10-3mol;则n(Fe2+)= 5bc×10-3mol,则样品中铁元素的质量分数是(10×5bc×10-3mol×56g/mol)÷a=2.8bc/a,故答案为:2.8bc/a。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关生物体化学成分的叙述正确的是( )
A.精瘦肉中含量最多的是蛋白质 |
B.组成细胞壁主要成分的单体是氨基酸 |
C.T2噬菌体的遗传物质含有硫元素 |
D.与精子形成相关的雄激素属于脂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应的理论是一个经过简化的概念模型,合理简化的概念模型是研究化学反应原理的基础。反应速率的碰撞理论提出:能引发化学反应的碰撞称为有效碰撞。
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是________(填“a”“b”或“c”)。
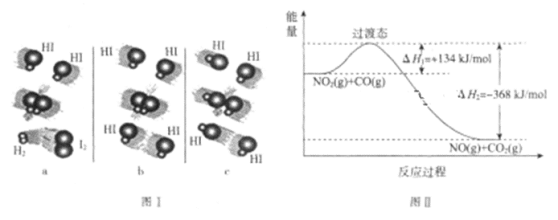
(2)过渡态理论是在碰撞理论的基础上提出的:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。根据图Ⅱ写出相应的热化学方程式:_____________________________________________ 。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了活化能从而改变了反应的途径。请在图Ⅱ中画出该反应在其他条件不变,仅使用催化剂而使反应速率加快的能量变化示意图。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中化学元素的叙述,正确的是
A. 细胞中一种元素的作用能被其他元素替代
B. 细胞中的所有物质都含有碳元素
C. 细胞膜上的物质运输有助于维持细胞内元素组成的相对稳定
D. 细胞中的微量元素因含量极少而不如大量元素重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对反应类型的判断不正确的是
A. CH3CHO+2Ag(NH3)2OH![]() CH3COONH4+2Ag↓+3NH3+H20 氧化反应
CH3COONH4+2Ag↓+3NH3+H20 氧化反应
B. ![]() 聚合反应
聚合反应
C.  取代反应
取代反应
D.  消去反应
消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③氢能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能
A.①②③④B.⑤⑥⑦C.③⑤⑥⑦D.③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机反应类型的以下判断不正确的是
A.苯乙烯与溴的CCl4溶液反应属取代反应
B.乙醇与氧气反应生成乙醛属氧化反应
C.乙醛与H2反应生成乙醇属加成反应
D.油脂在稀硫酸溶液中加热属水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)═2NO2(g),若N2O4的浓度由0.1molL﹣1降到0.07molL﹣1需要15s,那么N2O4的浓度由0.07molL﹣1降到0.05molL﹣1所需的反应时间( )
A. 等于5s B. 等于10s C. 小于10s D. 大于10s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 64g SO2中含有的原子数为3NA
B. 5.6g金属铁变为离子时失去的电子数为0. 3NA
C. 常温常压下,11.2L Cl2含有的分子数为0.5NA
D. 1mol/L NaOH溶液中Na+的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com