
| A. | ①③ | B. | ②④ | C. | ①② | D. | ②③ |
分析 ①摩尔质量单位是g/mol;
②依据n=$\frac{m}{M}$计算;
③1个硫原子含有16个电子;
④依据相对原子质量的定义计算解答.
解答 解:①该硫原子的摩尔质最是aNAg/mol,故错误;
②该硫原子的摩尔质最是aNAg/mol,mg该硫原子的物质的量为$\frac{m}{M}$=$\frac{m}{a{N}_{A}}$mol,故正确;
③ag该硫原的个数为1个,含有16个电子,故错误;
④该硫原子的相对原子质量=$\frac{ag}{\frac{b}{12}g}$=$\frac{12a}{b}$,故正确;
故选:B.
点评 本题考查了阿伏伽德罗常数,题目难度不大,熟悉物质的量、微粒个数、质量之间的换算、熟悉摩尔质量、相对原子质量的定义是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏烧瓶中盛约$\frac{1}{2}$体积的自来水,并放入几粒碎瓷片 | |
| B. | 将温度计水银球插到蒸馏烧瓶中的自来水中 | |
| C. | 冷水应从冷凝管下口进,上口出 | |
| D. | 收集到的液体取少量滴入硝酸银和稀硝酸,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
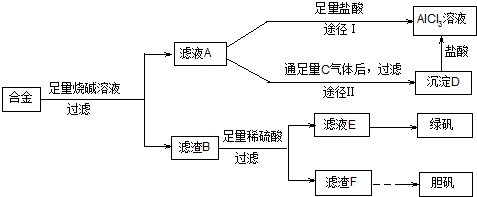
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
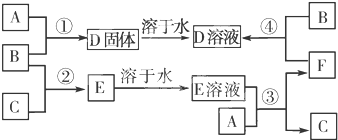
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
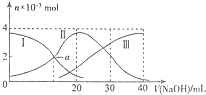 常温下,向20mL0.2mol•L-1H2C2O4溶液中滴加0.2mol•L-1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4,Ⅱ代表HC2O4-,Ⅲ代表C2O42-),根据图示判断,下列说法正确的是( )
常温下,向20mL0.2mol•L-1H2C2O4溶液中滴加0.2mol•L-1NaOH溶液.有关微粒物质的量的变化如图(其中I代表H2C2O4,Ⅱ代表HC2O4-,Ⅲ代表C2O42-),根据图示判断,下列说法正确的是( )| A. | H2C2O4在水中的电离方程式是:H2C2O4?2H++C2O42- | |
| B. | 当V(NaOH)=20mL时,溶液中水的电离程度比纯水小 | |
| C. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+2c(HC2O4-)+3c(H2C2O4)═c(C2O42-)+2c(OH-) | |
| D. | 已知H2C2O4的电离常数分别为K1、K2,则a点的c(H+)=K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com