
【题目】已知:![]() 是碳酸甲乙酯的工业生产原理。下图是投料比[
是碳酸甲乙酯的工业生产原理。下图是投料比[![]() ]分别为3:1和1:1、反应物的总物质的量相同时,
]分别为3:1和1:1、反应物的总物质的量相同时,![]() 的平衡转化率与温度的关系曲线。下列说法正确的是
的平衡转化率与温度的关系曲线。下列说法正确的是
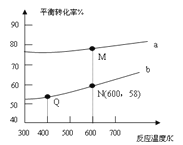
A.曲线b所对应的投料比为3:1
B.M点对应的平衡常数小于Q点
C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58
D.M点和Q点对应的平衡混合气体的总物质的量之比为2:1
【答案】C
【解析】
试题分析:A.由图可知,温度一定时曲线b表示碳酸甲酯的转化率低,增大某一反应的浓度,其它反应物转化率增大,自身转化率降低,则曲线b表示所对应的投料比为1:1,A项错误;B. 根据图像可知,升高温度,碳酸甲酯的平衡转化率增大,说明平衡向正反应方向移动,K值增大,则M点对应的平衡常数大于Q点,B项错误;C.由A分析可知曲线b表示所对应的投料比为3:1,由图中数据可知,N点平衡时碳酸甲酯的转化率为58%,反应前后混合气体的总的物质的量不变,则平衡混合气中碳酸甲乙酯的物质的量分数为(1mol×0.58×2)÷(1mol+1mol)=0.58,C项正确;D.开始反应物的总物质的量相同,反应前后混合气体的总的物质的量不变,故曲线a、b平衡时混合气体的物质的量相等,D项错误;答案选C。


科目:高中化学 来源: 题型:
【题目】(1)基态铜原子的核外未成对电子数目为___________。
(2)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。

(3)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
上述化学方程式中的5种物质所属的晶体类型有___________。
(4)BF3与一定量水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:
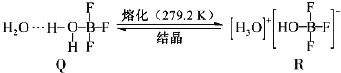
①晶体Q中各种微粒间的强相互作用力包括___________(填序号).
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
②R中阳离子的空间构型为___________,阴离子的中心原子轨道采用1个2s原子轨道与___________个___________原子轨道杂化。
(5)将铜粉加入浓氨水中.再通入氧气,充分反应后溶液呈深盔色(一种铜离子的配位化合物).
该反应的离子方程式为___________。
(6)金属铁为体心立方晶胞结构(钾型).则晶体中的配位数为___________;若晶体的密度为ρg/cm3,铁原子半径为___________cm(用含ρ和NA的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu及其化合物在科学研究和工业生产中具有许多用途。请回答以下问题:
(1)向CuSO4浓溶液中滴加氨水至深蓝色的透明溶液.再向其中加入适量乙醇,发生的离子反应方程式__________________________;
(2)硫酸铜溶液中滴入氨基乙酸钠(H2N—CH2COONa)即可得到配合物A,其结构如图:
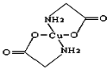
①SO42-中S原子的轨道杂化类型是________________;
②A中碳原子的轨道杂化类型为________________;
③1mol氨基乙酸钠含有δ键的数目为_________。
(3)元素金(Au)处于周期表中的第六周期,与Cu同族。一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为_________(填“密置层”、“非密置层”);该晶体中,原子之间的作用力是_________。
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的晶胞结构结构相似,该晶体储氢后的化学式应为_________,若Cu原子与Au原子的距离为acm,则该晶体储氢后的密度为_________。(含a的表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如下图装置①。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列叙述不正确的是
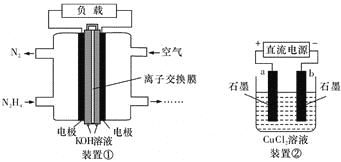
A. 该燃料电池负极发生的电极反应为:N2H4+4OH---4e-="=" N2+4H2O
B. 用该燃料电池作为装置②的直流电,产生1 mol Cl2至少需要通人 0.5 mol N2H4
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该燃料电池中,电子从右侧电极经过外电路流向左侧电极,溶液中OH-则迁移到左侧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气。
(1)已知:H2(g)+1/2O2(g)═H2O(g) △H1= —241.8 kJmol-1
2C(s)+O2(g)═2CO(g) △H2= —221 kJmol-1
由此可知焦炭与水蒸气反应的热化学方程式为
(2)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为
(已知:H2S:Ka1=1.3×10-7,Ka2=7.1×10-15;H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11)
(3)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH,得到两组数据
CO2(g)+H2(g) ΔH,得到两组数据
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡 所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
该反应的![]() H 0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
H 0(填“<”或“>”);若在9000C时,另做一组实验,在2L的恒容密闭容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时正 逆(填“<”,“>”,“=”)。
(4)一定条件下,某密闭容器中已建立A(g)+B(g)![]()
C(g)+D(g) △H>0的化学平衡,时间速率图像如右图,下列选项中对于t1时刻采取的可能操作及其平衡移动情况判断正确的是
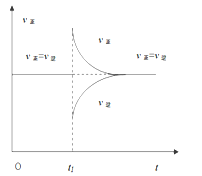
A.减小压强,同时升高温度,平衡正向移动
B.增加B(g)浓度,同时降低C(g)浓度,平衡不移动
C.增加A(g)浓度,同时降低温度,平衡不移动
D.保持容器温度压强不变通入稀有气体,平衡不移动
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H1<0
2N2(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g) +2NO2(g)![]() N2(g) +CO2(g) +2H2O(g) △H2<0
N2(g) +CO2(g) +2H2O(g) △H2<0
(5)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO)︰V (NO2)= 。

(6)在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图所示。写出Y和Z的化学式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
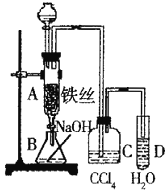
(1)写出A中反应的化学方程式______________________________;
(2)观察到D中的现象是______________________________;
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_______________;
(4)C中盛放CCl4的作用是______________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中先加入_________,再加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入__________,现象是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气肆虐给人类健康带来了严重影响。燃煤和汽车尾气 是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2C02(g)+N2 (g) △H <0 。
2C02(g)+N2 (g) △H <0 。
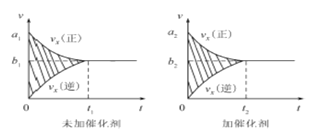
①该反应的速率时间图像如右图中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其速率时间图像如右图中右图所示。以下说法正确的是 (填对应字母)。
A.a1>a2 B.b1 <b2 C.t1>t2
D.右图中阴影部分面积更大 E.左图中阴影部分面积更大
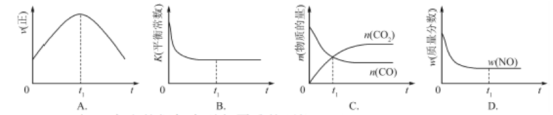
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。已知:CH4(g)+2N02(g) = N2(g)+C02(g)+2H20(g) △H=-867 kJ/mol
2N02(g)= N204(g) △H= - 56.9 kJ/mol H20(g) = H20(l) △H = - 44.0 kJ/mol
写出CH4催化还原N204 (g)生成N2和H20(1)的热化学方程式: 。
(3)CH4和H20(g)在催化剂表面发生反应CH4 + H20 = C0 + 3H2 ,该反应在不同温度下的化学平衡常数如下表:
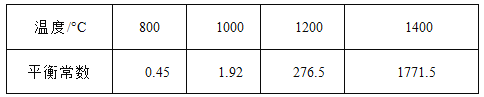
①该反应是 反应(填“吸热”或“放热 ”)。
②T℃时,向1L密闭容器中投入1mol CH4 和1mol H20(g),平衡时C(CH4)=0.5 mol·L-1 , 该温度下反应CH4 + H20 = CO+3H2的平衡常数K= 。
(4)甲烷燃料电池可以提升能量利用率。如图是利用甲烷燃料电池电解100mL lmol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24 L(设电解后溶液体积不变)。
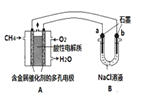
①甲烷燃料电池的负极反应式: 。
②电解后溶液的pH = , (忽略氯气与氢氧化钠溶液反应)。
③阳极产生气体的体积在标准状况下是 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
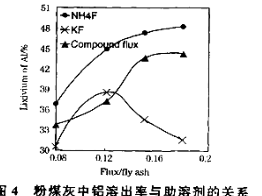
【题目】【化学—选修2:化学与技术】粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为:SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
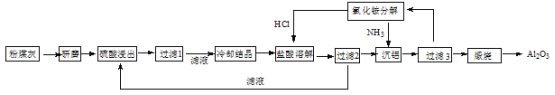
(1)粉煤灰研磨的目的是 。
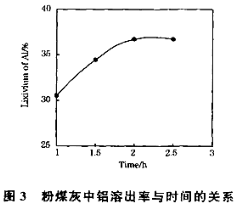
(2)第1次过滤滤渣的主要成分有 和 (填化学式, 下同),第3次过滤时,滤渣的成分的是 。
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如下图1,适宜的浸取时间为 h;铝的浸取率与“助溶剂/粉煤灰”的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及其NH4F与KF的混合物,在助溶剂/粉煤灰相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂缺点是 (举一例)。
(4)流程中循环使用的物质有 和 (填化学式)。
(5)用盐酸溶解硫酸铝晶体,能够发生的原因是 。
(6)用粉煤灰制取含铝化合物的主要意义是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:
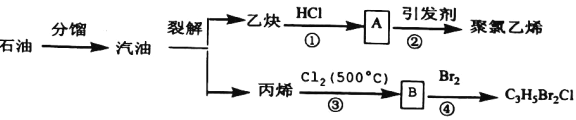
(1)写出反应②的化学方程式__________。
(2)B分子中无甲基,则B的结构简式为__________。系统命名为__________。
(3)反应①和③的类型依次是__________、__________。
(4)写出反应③化学方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com