
| A. | R为ⅡA族元素 | B. | R(OH)4是强碱 | ||
| C. | RCl2有还原性,容易被氧化 | D. | R2+的硝酸盐溶液呈中性 |
分析 已知R2+有5个电子层,其最外层有2个电子,则R原子最外层电子排布式为5s25p2,主族元素最外层电子数与其族序数相等,所以R属于第IVA族,为Sn元素,当把固体SnCl2溶于水配制成溶液时,需加入少量的固体Sn单质和盐酸,说明+2价Sn不稳定易被氧化,且该盐是强酸弱碱盐易水解,加入盐酸能抑制其水解.
解答 解:已知R2+有5个电子层,其最外层有2个电子,则R原子最外层电子排布式为5s25p2,主族元素最外层电子数与其族序数相等,所以R属于第IVA族,为Sn元素,当把固体SnCl2溶于水配制成溶液时,需加入少量的固体Sn单质和盐酸,说明+2价Sn不稳定易被氧化,且该盐是强酸弱碱盐易水解,
A.由分析可知,R属于第IVA族,故A错误;
B.当把固体SnCl2溶于水配制成溶液时,需加入少量的盐酸,说明SnCl2是强酸弱碱盐,易水解,所以Sn(OH)2是弱碱,R(OH)4也是弱碱,故B错误;
C.当把固体SnCl2溶于水配制成溶液时,需加入少量的固体Sn单质,说明+2价Sn不稳定易被氧化,故C正确;
D.SnCl2是强酸弱碱盐,易水解而使其溶液呈酸性,故D错误;
故选C.
点评 本题考查了元素的推断及元素周期律等知识点,先根据离子最外层电子排布式确定元素,再结合元素周期律、盐类水解、氧化还原反应等知识点来分析解答,难度中等.


科目:高中化学 来源: 题型:选择题
 最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )
最近有研究人员发现了一种处理高浓度乙醛废水的新方法-隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法正确的是( )| A. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入空气 | |
| B. | 电解过程中,生成0.1 mol乙酸的同时,有0.2 mol的乙醇生成 | |
| C. | 阳极反应CH3CHO-2e-+OH-═CH3COOH+H+ | |
| D. | 电解过程中两极除分别生成乙酸和乙醇外,均产生了无色气体,则阳极产生的是O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯(硝基苯):加少量蒸馏水振荡,静置分层后分液 | |
| B. | 乙醇(水):加新制的生石灰,蒸馏 | |
| C. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| D. | 环己烷(苯):通入氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
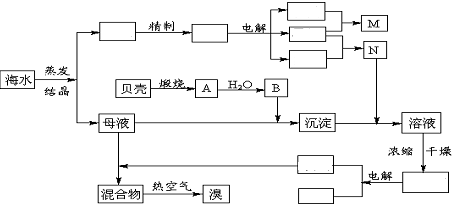
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第IVA族 | |
| C. | 与氢气化合时,Z比Y容易 | |
| D. | 甲中只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
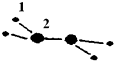 (1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图:
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示.测得M的摩尔质量为32g/mol.画出编号为2的原子结构示意图: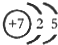 .
.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-1mol) | 4.3 | 5.9 | 6.0 |
| 实验① | 等体积1mol/L氨水和0.1mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1mol/L氨水和1mol/L MgCl2溶液混合 | 无现象 |
| 实验编号 | I-的初始浓度 (mol•L-1) | ClO-的初始浓度 (mol•L-1) | OH-的初始浓度 (mol•L-1) | 初始速率v (mol•L-1•s-1) |
| 1 | 2×10-3 | 1.5×10-3 | 1.00 | 1.8×10-4 |
| 2 | a | 1.5×10-3 | 1.00 | 3.6×10-4 |
| 3 | 2×10-3 | 3×10-3 | 2.00 | 1.8×10-4 |
| 4 | 4×10-3 | 3×10-3 | 1.00 | 7.2×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com