
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下图所示:
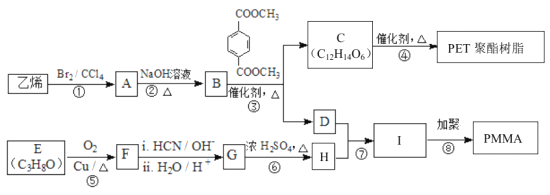
已知:Ⅰ. ![]()
Ⅱ. 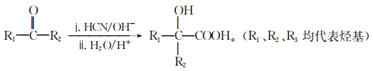
请回答下列问题:
(1) A的分子式是____________________;反应②的反应类型是____________________ 。
(2)已知F不能发生银镜反应,则PMMA的名称是 _______________________。
(3) 已知反应④的另一小分子产物是乙二醇,写出反应④的化学方程式:______________________。
(4)下列说法正确的是______________ (填字母代号)。
a.反应⑥为酯化反应
b. B和D互为同系物
c.D的沸点比含相同碳原子数的烷烃高
d.等质量的G分别与足量Na、NaHCO3溶液反应,生成的气体在相同状况下体积相等
(5)写出一种符合下列条件的Ⅰ的同分异构体的结构简式:_____________________________。
a.具有Ⅰ的所有官能团
b.能与新制银氨溶液反应产生银镜
c.含有3种不同化学环境的氢原子
【答案】 C2H4Br2 取代反应(或水解反应) 聚甲基丙烯酸甲酯(或聚2-甲基丙烯酸甲酯)  cd HCOOCH=C(CH3)2
cd HCOOCH=C(CH3)2
【解析】流程中,乙烯与Br2的CCl4溶液发生加成反应生成A为CH2BrCH2Br;CH2BrCH2Br在NaOH溶液中加热发生水解反应生成B为HOCH2CH2OH;HOCH2CH2OH与 发生反应③生成C和D,由已知Ⅰ,并结合C的分子式可得,C为
发生反应③生成C和D,由已知Ⅰ,并结合C的分子式可得,C为 、D为CH3OH;E分子式为C3H8O,发生反应⑤生成F,由反应条件可得E为醇,发生催化氧化生成F,又根据已知F不能发生银镜反应,则E为2-丙醇(
、D为CH3OH;E分子式为C3H8O,发生反应⑤生成F,由反应条件可得E为醇,发生催化氧化生成F,又根据已知F不能发生银镜反应,则E为2-丙醇(![]() ),F为丙酮(
),F为丙酮(![]() ),由已知Ⅱ,结合流程可得G为
),由已知Ⅱ,结合流程可得G为 ;G在浓硫酸、加热条件下发生消去反应生成H为
;G在浓硫酸、加热条件下发生消去反应生成H为![]() ,H(
,H(![]() )和D(CH3OH)发生酯化反应生成I为
)和D(CH3OH)发生酯化反应生成I为![]() ,I(
,I(![]() )发生加聚反应生成PMMA。
)发生加聚反应生成PMMA。
(1)由上述分析知,A为CH2BrCH2Br,故分子式为C2H4Br2;反应②为CH2BrCH2Br在NaOH溶液中加热生成B为HOCH2CH2OH,故反应类型为:取代反应(或水解反应)。
(2)由上述分析知,I(![]() )发生加聚反应生成PMMA,则PMMA为:
)发生加聚反应生成PMMA,则PMMA为: ,名称为:聚甲基丙烯酸甲酯(或聚2-甲基丙烯酸甲酯)。
,名称为:聚甲基丙烯酸甲酯(或聚2-甲基丙烯酸甲酯)。
(3)C为 ,流程中C发生反应④生成PET聚酯树脂,由已知反应④的另一小分子产物是乙二醇,则
,流程中C发生反应④生成PET聚酯树脂,由已知反应④的另一小分子产物是乙二醇,则 发生缩聚反应生成PET聚酯树脂,化学方程式为:n
发生缩聚反应生成PET聚酯树脂,化学方程式为:n
![]()
 +(n-1)HOCH2CH2OH。
+(n-1)HOCH2CH2OH。
(4)a项,由前面的分析可知,反应⑥为G( )发生消去反应生成H(
)发生消去反应生成H(![]() ),故a错误;b项,B为HOCH2CH2OH,D为CH3OH,二者不是同系物,故b错误;c项,D为CH3OH,常温下为液态,甲烷常温下为气态,所以D的沸点比含相同碳原子数的烷烃高,故c正确;d项,G为
),故a错误;b项,B为HOCH2CH2OH,D为CH3OH,二者不是同系物,故b错误;c项,D为CH3OH,常温下为液态,甲烷常温下为气态,所以D的沸点比含相同碳原子数的烷烃高,故c正确;d项,G为 ,醇羟基和羧基都能与Na反应生成氢气,只有羧基能与NaHCO3溶液反应产生CO2,所以等质量的G分别与足量Na、NaHCO3溶液反应,生成的气体在相同状况下体积相等,故d正确。
,醇羟基和羧基都能与Na反应生成氢气,只有羧基能与NaHCO3溶液反应产生CO2,所以等质量的G分别与足量Na、NaHCO3溶液反应,生成的气体在相同状况下体积相等,故d正确。
(5)I为![]() ,其同分异构体:a.具有Ⅰ的所有官能团,则含有酯基和碳碳双键;b.能与新制银氨溶液反应产生银镜,则含有醛基,所以应为甲酸酯;c.含有3种不同化学环境的氢原子,则结构简式为:HCOOCH=C(CH3)2。
,其同分异构体:a.具有Ⅰ的所有官能团,则含有酯基和碳碳双键;b.能与新制银氨溶液反应产生银镜,则含有醛基,所以应为甲酸酯;c.含有3种不同化学环境的氢原子,则结构简式为:HCOOCH=C(CH3)2。


科目:高中化学 来源: 题型:
【题目】如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
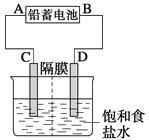
已知:铅蓄电池在放电时发生下列电极反应:
负极Pb+SO![]() -2e-===PbSO4
-2e-===PbSO4
正极PbO2+4H++SO![]() +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式_______________________________________。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量)时,
①若收集到11.2 L(标准状况下)氯气,溶液pH=_________________。
②若铅蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组探究镁与CO2、NO2的反应。
(1)实验发现点燃的镁条能在CO2气体中继续燃烧,产生黑、白两种固体,请用化学反应解释该现象_____。
(2)该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式_____。
(3)设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)。
资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O。

①装置A中的试剂是_____。
②干燥管和装置B的作用分别是_____、_____。
③实验开始时正确的操作步骤是_____。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:

已知:[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
A.气体X中含有SO2
B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O![]() CuO + 2HCl↑+ 4NH3↑
CuO + 2HCl↑+ 4NH3↑
D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
现用电子天平称取研细的黄铜矿样品1.150 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05 mol L-1标准碘溶液进行滴定,消耗标准碘溶液20. 00 mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是_____________________;标准碘溶液应盛放在___________(填“碱式”或“酸式”)滴定管中。
(2) a装置的作用是__________________(填字母代号)。
A.除去空气中的二氧化碳
B.除去空气中的水蒸气
C有利于气体混合
D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果_______________(填“偏低”“偏高”或“无影响”),写出影响测定结果的化学方程式:________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是___________________________。
(5)通过计算可知,该黄铜矿的纯度为_________________________。
(6) 假设实验操作均正确,测得的黄铜矿纯度仍然偏低,可能的原因主要有_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
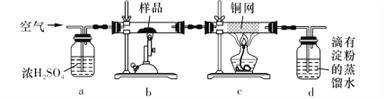
【题目】用如图所示各装置设计一个实验,验证浓硫酸与木炭粉在加热条件下反应产生的各种产物。

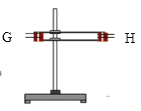
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
A接G,H接C,D接_______,_______接C,D接B ;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中_____________________________,丙中_____________________________;
(3)丁中酸性KMnO4溶液的作用是___________________________________________;
(4)写出甲中反应的化学方程式_________________________________________ 。
(5)硫酸有很多的性质,将下列性质对应的字母填入各小题后面对应的括号中:
A.脱水性 B.酸性 C.强氧化性 D.吸水性
Ⅰ.在化学实验中,浓硫酸可做SO2、CO2等气体的干燥剂。 (_______)
Ⅱ.Na2CO3与H2SO4反应,可生成Na2SO4和CO2。 (_______)
Ⅲ.向滤纸上滴加浓H2SO4 ,滤纸变黑。 (_______)
Ⅳ.在冷浓H2SO4中放入铁片没明显现象 (_______)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A. 氯气溶于水:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
B. Fe和盐酸反应:Fe+2H+ ═Fe3++H2↑
C. NO2溶于水的反应:3NO2+H2O ═ 2H+ + 2NO3- + NO
D. 氧化铜与硫酸反应:CuO+2H+═ Cu2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A. 能使广范pH试纸显红色的溶液:K+、Ba2+、Cl-、Br-
B. 含有大量Al3+的溶液:Na+、Cl-、HCO3-、SO42-
C. 能使淀粉碘化钾试纸显蓝色的溶液:K+、![]() 、S2-、SO32-
、S2-、SO32-
D. 常温下![]() =1012的溶液:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液:Fe2+、Mg2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是( )
A. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
B. 室温下,0.2mol·L-1的Na2SO4溶液中含Na+数目为0.4NA
C. 标准状况下,NA个HF分子所占的体积约为22.4L
D. 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com